Falschparkern in Krebszellen auf der Spur
10.03.2020In Plattenepithelkarzinomen sorgt ein spezielles Protein dafür, dass unbenötigte Proteine nicht mehr entsorgt werden. Ein Forschungsteam der Universität Würzburg hat dieses Protein erstmals ausgeschaltet.
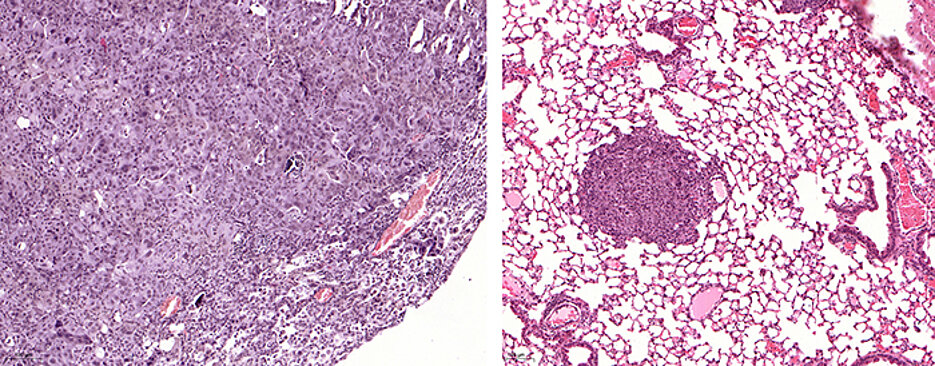
Plattenepithelkarzinome sind eine sehr außergewöhnliche Krebsart. Sie treten in vielen Geweben auf – zum Beispiel in Lunge, Speiseröhre, Bauchspeicheldrüse, Hals und Rachenraum sowie auf der Haut. Aufgrund der vielen Mutationen bei dieser Krebsart ist die Behandlung für die Medizin eine besonders große Herausforderung.
Jedoch besitzen alle Plattenepithelkarzinome eine gemeinsame Achillesferse: Sie sind vom Krebsprotein ∆NP63 abhängig. Dabei handelt es sich um ein Protein, das nur in dieser Tumorart vorkommt und essenzielle biologische Abläufe regelt.
Ein internationales Forschungsteam unter Federführung der Julius-Maximilians-Universität (JMU) Würzburg hat nun eine Möglichkeit gefunden, das Krebsprotein mit Hilfe eines anderen Proteins lahmzulegen und damit das Wachstum von Plattenepithelkarzinomen einzudämmen.
Strafzettel werden wieder wirksam
Das hilfreiche Protein ist die Deubiquitylase USP28. In den Plattenepithelkarzinomen kommt sie besonders häufig vor. Sie kontrolliert dort die Menge des Krebsproteins ∆NP63.
„Die Deubiquitylase gehört zum sogenannten Ubiquitin-Proteasom-System, das man sich wie ein Abschleppunternehmen vorstellen kann“, erklärt Dr. Markus Diefenbacher vom Lehrstuhl für Biochemie und Molekularbiologie I der JMU. Seine Forschungsgruppe war bei der Studie federführend.
„In gesunden Zellen markiert dieses Abschleppunternehmen falsch parkende Proteine mit einer Art Strafzettel, nämlich dem Protein Ubiquitin. Dann schleppt es die Falschparker ab und entsorgt sie. Das Protein USP28 kann aber den Strafzettel entfernen und damit das Abschleppen verhindern. In den Tumorzellen kommt es oft zum Verlust der Kontrolleure oder zu einem gehäuften Auftreten von USP28. Daher verhält es sich mit ∆NP63 in einer Tumorzelle ähnlich wie mit einem falsch geparkten Auto, bei dem permanent der Strafzettel entfernt wird“, erklärt Diefenbacher.
Kein direkter Angriff möglich
Das Forschungsteam konnte nun die Abhängigkeit der Plattenepithelkarzinome vom Protein USP28 beweisen: Mit einem Hemmstoff hat es den Strafzettelentferner von ∆NP63 in den Tumorzellen ausgeschaltet. Darauf stellten die Tumore ihr Wachstum ein.
„Viele Krebsproteine sind so gebaut, dass man mit den momentan verfügbaren Methoden keinen direkten Wirkstoff gegen sie entwickeln kann“, erklärt der Würzburger Forscher. Auch auf das Krebsprotein ΔNP63 sei kein direkter therapeutischer Angriff möglich. Mit dem Ausschalten von USP28 konnte jedoch das Krebsprotein in menschlichen und tierischen Tumorzellen schnell abgebaut und der Tumor bekämpft werden. Bei gesunden Zellen gab es gleichzeitig keine Nebenwirkungen. „Wir haben damit eine gute neue Möglichkeit entdeckt, um Plattenepithelkarzinome anzugreifen“, so Diefenbacher.
Suche nach weiteren Hemmstoffen
Für einen therapeutischen Einsatz am Menschen ist der verwendete Hemmstoff noch nicht geeignet. Er muss noch weiter erforscht werden. Dies erfolgt in Kollaboration mit der Arbeitsgruppe von JMU-Professorin Caroline Kisker am Rudolf-Virchow-Zentrum für experimentelle Biomedizin. Diefenbacher: „In der Krebstherapie werden schon Hemmstoffe verwendet, die das ganze Ubiquitin-Proteasom-System ausschalten. Unsere Arbeit zeigt jetzt eine Möglichkeit auf, nur einen Bestandteil dieses Systems abzuschalten und damit die Tumorzellen noch gezielter bekämpfen zu können.“
Als nächstes will Diefenbachers Team weitere Hemmstoffe suchen, die sich ebenfalls gegen USP28 einsetzen lassen. „Außerdem werden wir im Plattenepithelkarzinom nach weiteren Proteinen suchen, von welchen diese Tumore abhängig sind, und hinterfragen, ob auch hier das Ubiquitin-Proteasom-System ein potenzieller Angriffspunkt für Therapien sein kann“, so der JMU-Forscher.
Publikationspartner und Förderer
Die Studienergebnisse sind via Open Access im Fachjournal EMBO Molecular Medicine veröffentlicht. Daran beteiligt sind Gruppen der JMU (Biozentrum, Comprehensive Cancer Centre Mainfranken, Rudolf-Virchow-Zentrum, Medizinische Fakultät) sowie Forschungsteams des Universitätsklinikums Würzburg, der Universität Córdoba, des Instituto Maimónides de Investigación Biomédica Córdoba (IMIBIC), des Hospital Universitario Reina Sofía in Córdoba, des Technion Haifa in Israel und der Goethe-Universität Frankfurt.
Gefördert wurde die Studie durch die Deutsche Krebshilfe, die Deutsche Forschungsgemeinschaft, die German Israeli Foundation und das Interdisziplinäre Zentrum für Klinische Forschung Würzburg.
Publikation
Cristian Prieto-Garcia, Oliver Hartmann, Michaela Reissland, Fabian Braun, Thomas Fischer, Susanne Walz, Christina Schülein-Völk, Ursula Eilers, Carsten P. Ade, Marco A. Calzado, Amir Orian, Hans M. Maric, Christian Münch, Mathias Rosenfeldt, Martin Eilers und Markus E. Diefenbacher: „Maintaining protein stability of ∆Np63 via USP28 is required by squamous cancer cells“, 4. März 2020, EMBO Molecular Medicine, DOI: 10.15252/emmm.201911101
https://www.embopress.org/doi/full/10.15252/emmm.201911101
Kontakt
Dr. Markus Diefenbacher, Lehrstuhl für Biochemie und Molekularbiologie I, Biozentrum der Universität Würzburg, T +49 931 31-88167, markus.diefenbacher@uni-wuerzburg.de