Blutgerinnung: Molekulare Schaltstellen weisen den Weg
15.06.2017Wissenschaftlern der Uni Würzburg ist es gelungen, neue Details zum Regelkreis der Thrombozytenbildung zu entschlüsseln. Die Erkenntnisse könnten helfen, die Mechanismen hinter Blutungskrankheiten aufzuklären.
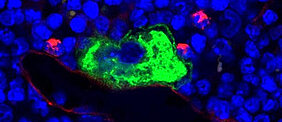
Thrombozyten, auch Blutplättchen genannt, spielen eine wichtige Rolle in der Blutgerinnung. Sie heften sich bei Verletzung eines Blutgefäßes an das umliegende Gewebe an und sorgen in einem dynamischen Prozess dafür, dass Verletzungen verschlossen und Heilungsprozesse ausgelöst werden. Da die Lebenszeit von Blutplättchen im Menschen etwa zehn Tage beträgt, müssen sie ständig neu gebildet werden.
Ihren Ursprung finden die Blutplättchen im Knochenmark, wo riesige Vorläuferzellen, die so genannten Megakaryozyten, nach einem komplexen Reifungsprozess die neuen Thrombozyten direkt in die Blutbahn abgeben. Ist dieser Prozess gestört, entstehen zu wenige oder fehlerhafte Blutplättchen, was mitunter lebensbedrohliche Blutungen zur Folge haben kann. Bis heute ist jedoch noch vieles über den Ablauf und die Regulation des Reifungsprozesses der Megakaryozyten und die Freisetzung der Blutplättchen unklar.
Folgenreiche Störungen der molekularen Schaltstellen
Forschern des Rudolf-Virchow-Zentrums für Experimentelle Biomedizin und des Universitätsklinikums Würzburg ist es nun gelungen, einen wichtigen Regelkreis dieses lebensnotwendigen Prozesses zu entschlüsseln. Die Arbeitsgruppe um Professor Bernhard Nieswandt identifizierte wichtige Faktoren in Megakaryozyten, welche deren Reifung und Orientierung hin zu den Blutgefäßen steuern. Dies ist wichtig, um eine normale Bildung der Blutplättchen zu ermöglichen.
Zu diesen Faktoren gehören vor allem die sogenannten Rho GTPasen. Das sind kleine Proteine, die in Zellen als molekulare Schaltstellen verschiedene Funktionen wie Bewegung und Orientierung im Gewebe regeln. "Mit unserer Arbeit konnten wir zeigen, dass ein Defekt oder gar das Fehlen einer dieser Schaltstellen dafür sorgt, dass Megakaryozyten ihre korrekte Orientierung verlieren und irrtümlich in das Blutgefäß einwandern können", sagt Professor Nieswandt, Leiter der Studie. Dadurch sei die normale Blutplättchenbildung unmöglich, was in Versuchsmäusen zu einer dramatisch verringerten Blutplättchenzahl und zu Blutungsproblemen geführt habe.
Diese überraschenden Befunde bilden nun die Grundlage für ein neues Verständnis, wie Blutplättchen im Knochenmark gebildet werden und könnten darüber hinaus auch für die Entstehung anderer Blutzellen bedeutsam sein.
Therapeutischer Ansatz bei Blutungskrankheiten
Von der Entdeckung dieses Rho-GTPase-Regelkreises bei der Blutplättchenbildung erwartet die Forscher grundlegende neue Einblicke in die Ursachen von Krankheiten wie dem Bernhard-Soulier Syndrom. Bei dieser Blutungskrankheit leiden betroffene Patienten unter einer stark verminderten Anzahl an Blutplättchen (Thrombozytopenie), was mit lebenslangen und vielfach schwerwiegenden Blutungskomplikationen verbunden ist.
„Aufbauend auf unseren Befunden könnten in Zukunft neue Wirkstoffe zur Behandlung von Erkrankungen, die mit gestörter Blutplättchenbildung einhergehen, entwickelt werden“, hofft Professor Nieswandt. Ihre neuen Erkenntnisse konnten die Würzburger Forscher jetzt zusammen mit einem internationalen Wissenschaftlerteam in einem Artikel in der Fachzeitschrift Nature Communications veröffentlichen.
Dütting, S. et al. (2017) A Cdc42/RhoA regulatory circuit downstream of glycoprotein Ib guides transendothelial platelet biogenesis. Nature Communications. 8, 15838 doi: 10.1038/ncomms15838
Kontakt
Prof. Dr. Bernhard Nieswandt (Lehrstuhlinhaber Experimentelle Biomedizin - vaskuläre Medizin, Rudolf-Virchow-Zentrum), T: (0931) 31-80405, bernhard.nieswandt@virchow.uni-wuerzburg.de
Katja Aurbach (Doktorandin, Lehrstuhl für Experimentelle Biomedizin - vaskuläre Medizin)
T: (0931) 31-99813, aurbach_K1@ukw.de
Dr. Frank Sommerlandt (Public Science Center, Rudolf-Virchow-Zentrum)
T: (0931) 31-88449, frank.sommerlandt@uni-wuerzburg.de