Blockade am Rezeptor
25.06.2018Wenn Chlamydien den menschlichen Körper befallen, startet das Immunsystem seine Abwehrmechanismen. Doch die Bakterien wissen sich zu wehren. Neue Details ihrer Strategie haben Würzburger Wissenschaftler jetzt entschlüsselt.
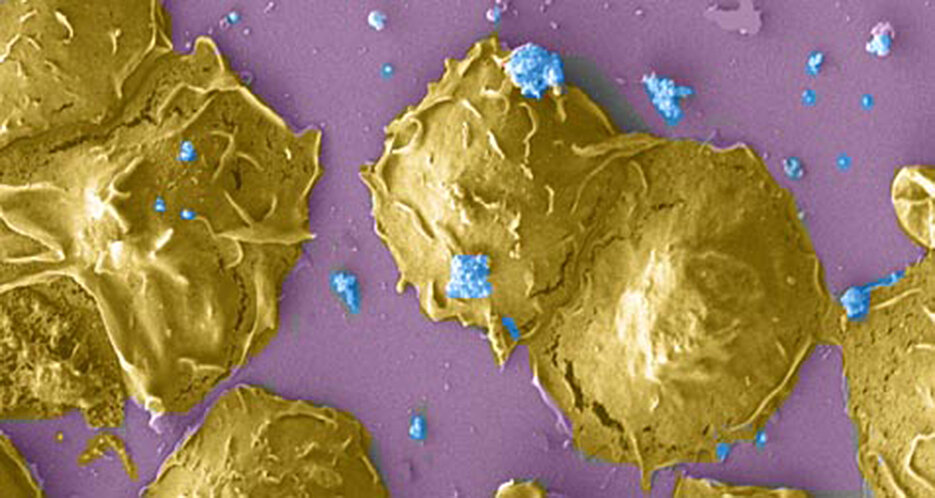
Chlamydia trachomatis ist der Hauptverursacher sexuell übertragbarer Krankheiten. Weltweit sind mehr als 131 Millionen Menschen mit dem Bakterium infiziert. Frühzeitig entdeckt und mit Antibiotika behandelt, lässt sich eine Chlamydien-Infektion in der Regel gut behandeln. Allerdings verläuft eine solche Infektion in der Regel ohne spürbare Symptome und bleibt deshalb in einer Vielzahl der Fälle unbemerkt. Dies erleichtert die Ausbreitung des Erregers und erhöht die Wahrscheinlichkeit für weitere Infektionen, beispielsweise mit dem HI-Virus oder mit dem Erreger der Gonorrhoe Neisseria gonorrhoeae.
Wie schafft es Chlamydia trachomatis, sich dem Angriff des menschlichen Immunsystems zu entziehen und damit auch die typischen Symptome einer Infektion zu unterdrücken? Eine Antwort auf diese Frage liefert eine neue Studie von Wissenschaftlern der Julius-Maximilians-Universität Würzburg (JMU). Dr. Karthika Rajeeve und Professor Thomas Rudel, Inhaber des Lehrstuhls für Mikrobiologie, konnten zeigen, dass das Bakterium spezielle Zellen des Immunsystems, sogenannte polymorph-nukleare Leukozyten (PMNs), aktiv ausschaltet und damit sein eigenes Überleben sichert. In der aktuellen Ausgabe der Fachzeitschrift Nature Microbiology stellen sie die Ergebnisse ihrer Arbeit vor.
Mit Fallen auf Erregerfang
Der Kampf zwischen Erreger und Immunsystem folgt beim Menschen einem festen Muster: Nach einer Infektion nehmen spezielle Leukozyten, die Teil der angeborenen Immunabwehr sind, die Arbeit auf. Sie können zum einen die Krankheitserreger aufnehmen und verdauen. Zum zweiten sondern sie spezielle Substanzen ab, die die Bakterien in der Umgebung schädigen. Und zum dritten bilden sie Strukturen, die manche Mikroorganismen binden und dadurch unschädlich machen können – in der Fachsprache neutrophil extracellular traps oder neutrophile außerzelluläre Fallen genannt. Allerdings haben etliche Krankheitserreger im Laufe der Evolution Mechanismen entwickelt, mit denen sie ihrerseits diese Fallen zerstören können – so auch Chlamydia trachomatis.
„Aus früheren Studien war bereits bekannt, dass Chlamydien einzelne Schritte der angeborenen Immun-Signalwege stören. Der genaue Mechanismus war bisher jedoch unbekannt“, erklärt Thomas Rudel. Jetzt ist es den Wissenschaftlern der JMU gelungen, zentrale Details dieser „Störaktion“ zu entschlüsseln: „Wir konnten nachweisen, dass freie Chlamydien auch bei direkter Interaktion keine PMNs aktivieren. Sobald PMNs Chlamydien angreifen, sind diese Zellen gelähmt und reagieren nicht mehr auf die Aktivierung durch verschiedene Reize“, sagt Rudel.
Ein Protein spaltet den Rezeptor
Zwei Rezeptoren und ein spezielles Protein haben die Forscher als zentrale Akteure in diesem Kampf der Bakterien gegen das Immunsystem identifiziert – die Formylpeptid-Rezeptoren vom Typ 1 (FPR1) und vom Typ 2 (FPR2) sowie den „Chlamydialen Protease-ähnlichen Aktivierungsfaktor“ (CPAF). Beide Rezeptoren bilden sozusagen die „Antennen“ der Immunzellen. Erkennen sie potenzielle Angreifer, geben sie ein Signal ans Zellinnere weiter und leiten damit die Abwehrreaktion ein. Während FPR1 nur spezielle Peptide spezifisch erkennt, kann FPR2 eine größere Bandbreite von Proteinen, Peptiden und Lipiden binden.
Wie es Chlamydien schaffen, diesen Aktivierungsprozess zu unterbinden, haben Rudel und sein Team jetzt aufgedeckt: „Wir haben CPAF als die Substanz identifiziert, die die angeborene Immunantwort blockiert“, sagt Rudel. In ihren Experimenten konnten die Wissenschaftler zeigen, dass Chlamydien, die kein CPAF bilden konnten, problemlos von den Immunzellen erkannt und anschließend effizient abgetötet wurden.
Darüber hinaus ist es ihnen gelungen, den Formylpeptid-Rezeptor 2 als Ziel von CPAF zu identifizieren. „FPR2 wird von CPAF gespalten und von der Oberfläche der Immunzellen entfernt“, schildert Rudel das zentrale Ergebnis der neuen Studie. Im Unterschied dazu bleibt das verwandte FPR1 in infizierten Zellen intakt und vermittelt weiterhin seine Signale. „Allerdings scheinen diese FPR1-Signalwege bei infizierten Immunzellen nicht aktiviert zu sein“, so Karthika Rajeeve.
Potenzial für neue Medikamente
Die Tatsache, dass CPAF außerhalb der Zelle eine zentrale Rolle in dem Infektionsprozess spielt, birgt nach Ansicht der Wissenschaftler die Chance für neue Medikamente gegen den Erreger. Eine Substanz, die CPAF blockiert, könne ein geeignetes Therapeutikum gegen Chlamydien-Infektionen sein. Dafür sei allerdings ein weiter vertieftes Verständnis der Strategien, die Chlamydien zur Lähmung des angeborenen Immunsystems des Wirtes anwenden, nötig.
Chlamydia trachomatis paralyses neutrophils to evade the host innate immune response. Karthika Rajeeve, Sudip Das, Bhupesh K. Prusty, Thomas Rudel. Nature Microbiology.
Kontakt
Prof. Dr. Thomas Rudel, Lehrstuhl für Mikrobiologie
T (0931) 31-84401, Thomas.Rudel@biozentrum.uni-wuerzburg.de