Schalter für DNA-Reparatur-Werkzeug entdeckt
14.04.2020Forscher der Universitäten Würzburg und Strasbourg haben einen neuen Bereich in einem menschlichen DNA-Reparatur-Komplex entdeckt. Das könnte für neue Ansatzpunkte in der Krebstherapie sorgen.
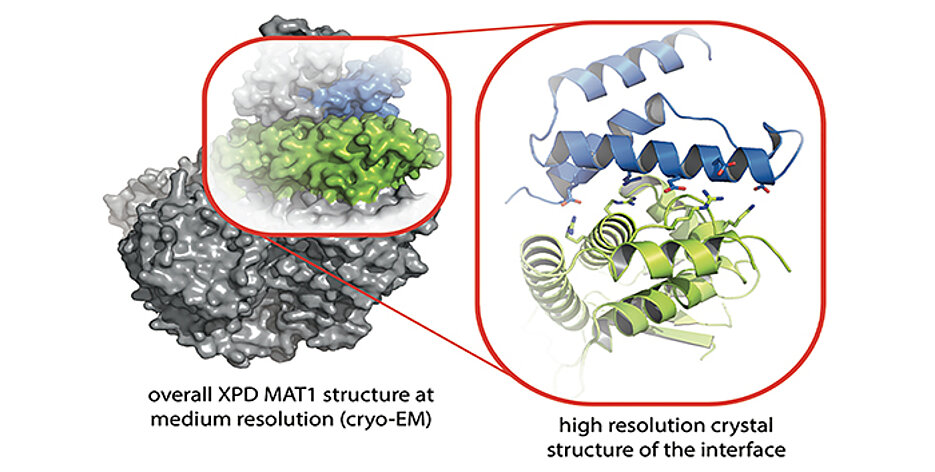
Wissenschaftler der Universität Würzburg und der Universität Strasbourg haben einen neuen wichtigen molekularen Bereich in einem essentiellen menschlichen DNA-Reparatur-Komplex identifiziert, bestehend aus den Proteinen XPD und MAT1. Dieser Komplex bildet eine zentrale Einheit im Nukleotid-Exzisions-DNA-Reparaturmechanismus (NER) und schützt somit unsere Erbinformationen. Die Erkenntnisse wurden im Fachjournal Nature Communications veröffentlicht und könnten neue Ansatzpunkte für die Krebstherapie liefern.
Das Erbgut des Menschen ist ständig schädlichen Einflüssen ausgesetzt, zum Beispiel dem UV-Licht der Sonne. Werden diese Schäden in der DNA nicht rechtzeitig repariert, können Krebserkrankungen oder vorzeitiges Altern die Folge sein. Unser Organismus hat im Laufe der Zeit effiziente Reparaturmechanismen entwickelt, die verschiedenen Schädigungen im Erbgut entgegenwirken können. Die NER ist einer dieser Mechanismen. Um diese komplexen biologischen Prozesse zu koordinieren, ist es von größter Wichtigkeit, dass alle beteiligten Komponenten streng reguliert und aufeinander abgestimmt sind. Das XPD-Protein nimmt dabei eine Schlüsselstellung in der DNA-Reparatur ein.
Wichtige funktionale Region in der DNA-Reparatur identifiziert
Um das Zusammenspiel der beteiligten Proteine besser zu verstehen, analysierten die Arbeitsgruppen von Professorin Caroline Kisker vom Rudolf-Virchow-Zentrum für Experimentelle Biomedizin der Julius-Maximilians-Universität (JMU) Würzburg und Professor Jean Marc Egly vom Institut de Génétique et de Biologie Moléculaire et Cellulaire der Universität Strasbourg (Frankreich) deren molekulare Struktur.
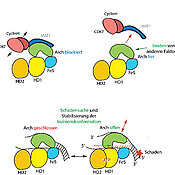
Die beiden Forschungsgruppen konnten in einem kombinatorischen Ansatz jetzt eine neue funktionale Region im XPD-Protein identifizieren, welche sowohl mechanistisch für die XPD-Aktivität als auch für die Interaktion mit anderen Proteinen zentral ist. „Unsere strukturbiologischen Analysen haben es ermöglicht, den Mechanismus der XPD-Regulation durch MAT1 aufzuschlüsseln, was wiederum wichtige Rückschlüsse auf die XPD-Funktion zulässt“, berichtet Kisker.
MAT1 ist wichtigster Interaktionspartner
Eine zentrale Einheit der NER ist der Protein-Komplex TFIIH, der aus zehn Untereinheiten besteht. Dem Protein XPD kommt im TFIIH eine Schlüsselrolle zu, sowohl bei der DNA-Reparatur als auch bei der Transkription, also dem normalen Ablesen der DNA. Allerdings darf das Protein ausschließlich während seiner Reparaturfunktion als Enzym aktiv sein. Wie das XPD für die verschiedenen Situationen an- und ausgeschaltet wird, konnten die Wissenschaftler nun zeigen: Das Protein MAT1 ist als Interaktionspartner für die Steuerung enorm wichtig.
Den Forschungsgruppen gelang es, die molekulare dreidimensionale Struktur (Kristallstruktur) der XPD-Arch-Domäne und seinen Interaktionspartner MAT1 zu identifizieren. „Dies hat es uns ermöglicht, funktional wichtige Bereiche innerhalb des Interaktionsbereiches im XPD-Protein zu analysieren, die unerlässlich für eine funktionale NER sind“, erklärt Dr. Jochen Kuper. Zum einen sind diese Bereiche direkt mit der Aktivität des Proteins verbunden und zum anderen regulieren sie nachfolgende Prozesse durch die Rekrutierung und Positionierung von wichtigen „downstream“ NER-Komponenten. Ist MAT1 an XPD gebunden, werden diese Bereiche verdeckt und XPD ist inaktiv.
XPD in der Krebstherapie
Auch in Zukunft wird die Funktion der NER stark im Fokus stehen, da dieser Mechanismus auch bei der Behandlung von Krebserkrankungen eine Rolle spielt. Viele Krebs-Chemotherapeutika greifen die DNA von Krebszellen an, verursachen erhebliche Schäden in ihrem Genom und führen damit zum Tod der Krebszellen. Ein effektiver DNA-Reparaturmechanismus in den Krebszellen kann dies aber verhindern und somit die Wirkung des Therapeutikums stark abschwächen. Die DNA-Reparaturinhibitoren eröffnen somit einen attraktiven Weg in der Krebsbehandlung.
„Bereits jetzt sehen wir, dass die NER wichtige Zielstrukturen für die Krebstherapie liefern kann. Gerade das XPD-Protein nimmt aufgrund seiner zentralen Bedeutung hier eine Schlüsselstellung ein“, betont Kisker. „Wir arbeiten gerade intensiv daran, weitere zentrale Komponenten des TFIIH zu analysieren, um deren Struktur-Funktionsbeziehung zu klären. Außerdem haben wir eine Kampagne initiiert, um Wirkstoffe gegen das XPD-Protein zu identifizieren und sie auf ihre therapeutische Nutzbarkeit zu überprüfen“, ergänzen Kisker und Kuper.
Publikation
Stefan Peissert, Florian Sauer, Daniel B. Grabarczyk, Cathy Braun, Gudrun Sander, Arnaud Poterszman, Jean-Marc Egly, Jochen Kuper and Caroline Kisker: In TFIIH the Arch domain of XPD is mechanistically essential for transcription and DNA repair. Nature Communications (April 2020), doi 10.1038/s41467-020-15241-9
Kontakt
Prof. Dr. Caroline Kisker, Lehrstuhl Strukturbiologie, Rudolf-Virchow-Zentrum, Universität Würzburg, T +49 931 31-80381, caroline.kisker@virchow.uni-wuerzburg.de