Ko-Infektion: Die Summe ist mehr als ihre Teile
24.11.2020Infektionen mit zwei Erregern stellen in der Klinik ein großes Problem dar. Forscher aus Würzburg und Jena haben eine Technik entwickelt, die neue Einblicke in diese Prozesse liefert. Sie eignet sich auch als Frühwarnsystem.
Organ- und Stammzelltransplantationen sind heutzutage im klinischen Alltag bewährte und häufig eingesetzte Methoden. Doch auch wenn sie an spezialisierten Zentren oft durchgeführt werden, kommt es bei den Patientinnen und Patienten im Anschluss daran immer wieder zu einer Reihe schwerer Komplikationen. Unter anderem Infektionen mit Pilzen und Viren können dann den Erfolg der Therapie gefährden. Gefürchtet ist beispielsweise das gemeinsame Auftreten des Zytomegalievirus – ein zur Familie der Herpesviren gehörendes Virus – und des Pilzes Aspergillus fumigatus. Diese Kombination von Krankheitserregern stellt eine ernsthafte medizinische Bedrohung bei der Organ- und Stammzelltransplantation dar.
Wenn Viren und Pilze sich verbünden
Ein Team von Wissenschaftlerinnen und Wissenschaftlern aus mehreren deutschen Forschungseinrichtungen und Kliniken hat jetzt eine neue Methode entwickelt, mit der es diese beiden Erreger und deren Interaktion sowohl untereinander als auch mit den von ihnen infizierten menschlichen Zellen unter die Lupe genommen hat. Das zentrale Ergebnis: Die Ko-Infektion mit den beiden Erregern ist mehr „als die Summe ihrer Teile“. Viren und Pilze wirken im menschlichen Organismus synergistisch zusammen und aktivieren dort einige Gene, die nur bei der gleichzeitigen Infektion mit den beiden Erregern aktiv werden.
An der Studie beteiligt waren Wissenschaftlerinnen und Wissenschaftler der Julius-Maximilians-Universität Würzburg (JMU), des Würzburger Universitätsklinikums (UKW), vom Leibniz-Institut für Naturstoff-Forschung und Infektionsbiologie in Jena sowie vom Helmholtz-Institut für RNA-basierte Infektionsforschung (HIRI) in Würzburg. Die Ergebnisse haben sie jetzt in der aktuellen Fachzeitschrift Cell Reports veröffentlicht.
Neue Einblicke dank einer neuen Technik
„Wir haben für unsere Studie ein Verfahren namens Triple-RNA-seq entwickelt“, erklärt Alexander Westermann. Er ist Juniorprofessor am Lehrstuhl für Molekulare Infektionsbiologie I der JMU sowie Gruppenleiter am HIRI und gemeinsam mit Professor Jürgen Löffler vom UKW einer der Hauptautoren der jetzt veröffentlichten Studie. Die Wissenschaftler haben dafür ein Verfahren weiterentwickelt, das seit etlichen Jahren fester Bestandteil der Infektionsforschung ist.
RNA-Sequenzierung: Diese Technik ermöglicht es, in einem Hochdurchsatzverfahren gleichzeitig die Aktivitäten tausender Gene auf RNA-Ebene präzise zu bestimmen und damit die im Rahmen von Erkrankungen auftretenden Veränderungen zu erkennen und besser zu verstehen. Ihre Weiterentwicklung – die duale RNA-Sequenzierung – erlaubt es im Unterschied dazu, nicht nur die Genaktivität eines Krankheitserregers zu dokumentieren, sondern gleichzeitig auch die Reaktion der von ihm befallen Wirtszelle. Damit ist es möglich, komplexe Kausalketten im zeitlichen Verlauf einer Infektion nachzuvollziehen.
Forschung an Immunzellen
Und nun also die Erweiterung auf die Genexpression von drei Akteuren in ihrem Wechselspiel – die Triple-RNA-Sequenzierung. „Bislang weiß die Wissenschaft in vielen Fällen nicht, warum eine Infektion mit einem bestimmten Erreger den Betroffenen für eine Sekundärinfektion mit einem zweiten Erreger anfälliger machen kann“, erklärt Jürgen Löffler, Molekularbiologe an der Medizinischen Klinik II des UKW. In solchen Fällen habe auch die duale RNA-seq nicht die gewünschten Antworten liefern können.
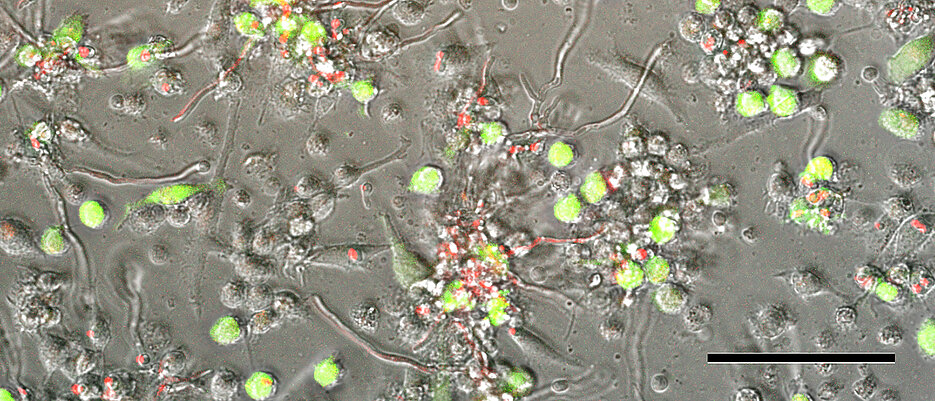
In ihrer Studie haben die Forscherinnen und Forscher mit der von ihnen entwickelten Triple-RNA-seq-Methode untersucht, was passiert, wenn bestimmte Zellen des Immunsystems – sogenannte von Monozyten abgeleitete dendritische Zellen – sowohl mit Aspergillus fumigatus als auch mit dem humanen Zytomegalievirus infiziert sind.
Dabei konnten sie nachweisen, dass die beiden Erreger sich gegenseitig beeinflussen und damit gleichzeitig auf die Immunzelle einwirken – und das auf eine andere Weise, als es ein Erreger alleine bewirken könnte. Beispielsweise schwächte das Zytomegalievirus die durch den Pilz vermittelte Aktivierung entzündungsfördernder Signalketten ab, während Aspergillus fumigatus die virale Clearance beeinträchtigt – also die Zeit, die es dauert, bis das Virus in Tests nicht mehr nachweisbar ist.
Hoffnung auf einen Biomarker
Gleichzeitig hat das Team spezielle Gene in den Immunzellen identifiziert, deren Expression sich während einer gemeinsamen Infektion beider Erreger im Vergleich zu einer Einzelinfektion signifikant unterscheidet. Diese könnten somit als Biomarker für eine zeitnahe Identifizierung einer Ko-Infektion nach einer Transplantation dienen.
Die Wissenschaftler hoffen nun, dass es mit Hilfe der Triple-RNA-seq-Technologie gelingt, auch andere Fälle gemeinsamer Infektionen – etwa von Viren und Bakterien – besser zu verstehen und deren häufig schwerwiegende Folgen zu verhindern. „Vielversprechende Modelle zum Verständnis, wie eine Infektion den Wirt anfälliger für einen weiteren Erreger macht, sind unter anderem bestimmte Salmonellen und das Humane Immundefizienz-Virus (HIV), Streptokokken und das Influenzavirus oder Chlamydien und das menschliche Herpesvirus“, sagt Westermann. Er selbst will allerdings in einem nächsten Schritt mit der Triple-RNA-seq-Technik Infektionen erforschen, bei denen zwei unterschiedliche Bakterienarten gemeinsam den Krankheitsverlauf beeinflussen.
Förderer
Finanziell unterstützt wurde diese Arbeit durch die Deutsche Forschungsgemeinschaft (DFG), Projekt 210879364, CRC TR124 FungiNet, sowie vom Helmholtz-Institut für RNA-basierte Infektionsforschung mit Mitteln des bayerischen Staatsministeriums für Wirtschaft, Landesentwicklung und Energie.
Originalpublikation
Triple RNA-seq reveals synergy in a human virus-fungus co-infection model. Bastian Seelbinder, Julia Wallstabe, Lothar Marischen, Esther Weiss, Sebastian Wurster, Lukas Page, Claudia Löffler, Lydia Bussemer, Anna-Lena Schmitt, Thomas Wolf, Jörg Linde, Luka Cicin-Sain, Jennifer Becker, Ulrich Kalinke, Jörg Vogel, Gianni Panagiotou, Hermann Einsele, Alexander J. Westermann, Sascha Schäuble, Juergen Loeffler. Cell Reports, DOI: 10.1016/j.celrep.2020.108389
Kontakt
Prof. Dr. Alexander J. Westermann, Lehrstuhl für Molekulare Infektionsbiologie I, T: +49 931 31-83781, alexander.westermann@uni-wuerzburg.de
Prof. Dr. Jürgen Löffler, Medizinische Klinik II, T: +49 931 20136412, loeffler_j@ukw.de