Kleines Protein, große Wirkung
04.06.2020In Meningokokken spielt das unscheinbare Protein ProQ eine tragende Rolle. Zusammen mit RNA-Molekülen reguliert es Prozesse, die für die krankmachenden Eigenschaften der Bakterien von Bedeutung sind.
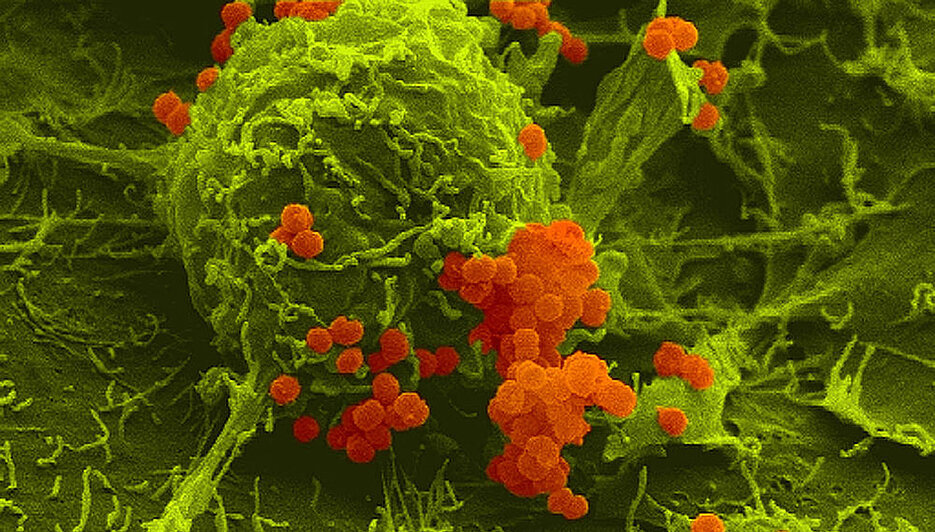
Meningokokken sind Bakterien, die lebensbedrohliche Hirnhautentzündungen und Sepsis auslösen können. Diese Krankheitserreger besitzen ein sehr kleines Protein, das einen sehr großen Einfluss hat: Es heißt ProQ und wirkt bei der Aktivierung von mehr als 250 bakteriellen Genen mit.
ProQ sorgt dafür, dass die Meningokokken Schäden an ihrer DNA besser reparieren können. Und es macht sie widerstandsfähig gegen oxidativen Stress. Beides trägt wesentlich zu den krankmachenden Eigenschaften der Bakterien bei.
Das berichten Forschungsgruppen um die Würzburger Wissenschaftler Christoph Schoen und Jörg Vogel im Journal Nature Communications.
„Wir waren überrascht davon, dass ein vergleichsweise kleines Protein solch einen großen Einfluss auf die bakterielle Genregulation haben kann“, sagt Christoph Schoen, Professor am Institut für Hygiene und Mikrobiologie der Julius-Maximilians-Universität (JMU) Würzburg. ProQ besteht aus nur rund 120 Aminosäuren. Zum Vergleich: Mittelgroße Proteine sind in der Regel aus mehreren hundert Aminosäuren aufgebaut.
ProQ tritt in Wechselwirkung mit 200 RNAs
Das Mini-Protein gehört zur Gruppe der RNA-Bindeproteine. RNA-Moleküle spielen als Regulatoren in vielen biologischen Prozessen eine wichtige Rolle. Dabei üben sie ihre Funktionen oft im Verbund mit den Bindeproteinen aus.
ProQ ist auch in dieser Hinsicht ein großer Player: „In Meningokokken geht es mit fast 200 verschiedenen RNA-Molekülen Wechselwirkungen ein“, so Jörg Vogel. „Es bindet dabei an stark strukturierte Regionen der RNA und stabilisiert so seine Bindepartner.“
Das fanden die Forscher mit modernen Hochdurchsatzverfahren heraus. Entwickelt wurden diese Methoden unter anderem in Vogels Arbeitsgruppe am Würzburger Helmholtz-Institut für RNA-basierte Infektionsforschung (HIRI). Vogel ist Direktor des HIRI und Leiter des JMU-Instituts für Molekulare Infektionsbiologie.
Neue Wirkstoffe gegen Bakterien gesucht
Für die Vorgänge in Bakterien interessieren sich die Würzburger Forscher, weil sie neue Angriffspunkte für antibakterielle Wirkstoffe finden möchten. Gerade die von RNA und ihren Bindeproteinen regulierten Prozesse bieten ein aussichtsreiches Betätigungsfeld. „Wir hoffen, die Bindeproteine mit relativ einfach gebauten Wirkstoffen in ihrer Funktion stören zu können und damit die Krankheitserreger zu schwächen“, erklärt Vogel.
Ziel: Alle RNA-Bindeproteine identifizieren
Für zwei Drittel aller RNA-Klassen in Meningokokken sind die zugehörigen Bindeproteine noch nicht identifiziert. Das wirft Fragen auf: Brauchen vielleicht die meisten RNAs zur Ausübung ihrer regulatorischen Funktion in Bakterienzellen gar keine Proteine? Und welche Prozesse werden durch die RNA-Bindeproteine überhaupt reguliert?
„Das möchten wir herausfinden, und dafür eignen sich Meningokokken wegen ihres relativ überschaubaren Erbguts besonders gut“, sagt Schoen. „Unser Ziel ist es, den gesamten Bestand an RNA-Bindeproteinen in Meningokokken mit etablierten Hochdurchsatzverfahren systematisch zu identifizieren.“
Publikation
The minimal meningococcal ProQ protein has an intrinsic capacity for structure-based global RNA recognition. Nature Communications, 4. Juni 2020, Open Access, DOI: 10.1038/s41467-020-16650-6
Kontakt
Prof. Dr. Dr. Christoph Schoen, Institut für Hygiene und Mikrobiologie, Universität Würzburg, T +49 931 31-46162, cschoen@hygiene.uni-wuerzburg.de
Prof. Dr. Jörg Vogel, Helmholtz-Institut für RNA-basierte Infektionsforschung Würzburg, T +49 931 31-82575, joerg.vogel@helmholtz-hiri.de
Förderer
Finanziell gefördert wurde diese Forschungsarbeit vom Bayerischen Staatsministerium für Wirtschaft, Landesentwicklung und Energie sowie vom Interdisziplinären Zentrum für Klinische Forschung (IZKF) Würzburg.
Fakten zum HIRI
Das Helmholtz-Institut für RNA-basierte Infektionsforschung (HIRI) wurde im Mai 2017 als gemeinsame Einrichtung des Braunschweiger Helmholtz-Zentrums für Infektionsforschung (HZI) und der Julius-Maximilians-Universität Würzburg (JMU) gegründet. Mit Sitz auf dem Campus des Würzburger Uniklinikums widmet sich das HIRI als weltweit erstes Institut seiner Art der Rolle von Ribonukleinsäuren (RNAs) in Infektionsprozessen. Auf Basis dieser Erkenntnisse werden in einem integrativen Forschungsansatz neue Therapieansätze entwickelt und durch Entwicklung pharmazeutischer Anwendungsformen klinisch anwendbar gemacht. www.helmholtz-hiri.de