Das Start-Stopp-System jagender Immunzellen
18.06.2021Wie Immunzellen ihr Schwarmverhalten koordinieren, um Krankheitserreger effektiv zu eliminieren: Eine Publikation in „Science“ stellt neue Erkenntnisse vor.
Der Körper ist durch Barrieren wie die Haut gut vor dem Eindringen von Krankheitserregern geschützt. Doch bei Verletzungen können Erreger leicht in den Körper gelangen und schwere Infektionen verursachen. Wenn das geschieht, übernimmt das angeborene Immunsystem die erste Verteidigungslinie. Dafür steht ihm ein effektives Arsenal zellulärer Waffen zur Verfügung.
Als einer der ersten Zelltypen vor Ort tauchen neutrophile Granulozyten auf, auch kurz Neutrophile genannt. Sie werden innerhalb weniger Stunden aus dem Blutkreislauf in das verletzte Gewebe rekrutiert, um möglichst schnell potentielle mikrobielle Eindringlinge zu zerstören.
Neutrophile machen etwa 50 bis 70 Prozent der weißen Blutkörperchen im menschlichen Körper aus. Man schätzt, dass bei einem Erwachsenen jeden Tag etwa 100 Milliarden Neutrophile aus Stammzellen im Knochenmark gebildet werden.
Schwärme bekämpfen die Infektion
„Neutrophile sind besonders effektiv beim Jagen und Töten von Bakterien“, sagt Tim Lämmermann. Der Forschungsgruppenleiter am Max-Planck-Institut (MPI) für Immunbiologie und Epigenetik in Freiburg erforscht diesen wichtigen Zelltyp.
„Diese Zellen patrouillieren in fast alle Ecken unseres Körpers, und sie sind echte Spezialisten darin, alles potentiell Schädliche aufzuspüren. Sobald einzelne Neutrophile geschädigte Zellen oder eindringende Keime im Gewebe entdecken, rufen sie weitere Zellen zur Hilfe. Dies geschieht über Botenstoffe, die von Rezeptoren an der Zelloberfläche der Neutrophilen erkannt werden.“
Durch diese Kommunikation können Neutrophile gemeinsam als Zellkollektiv agieren und im Schwarm die Beseitigung von Krankheitserregern effektiv koordinieren.
Schmaler Grat zwischen Schutz und Zerstörung
Diese nützliche Entzündungsreaktion kann aber auch überschießen. Die von den Neutrophilen freigesetzten Substanzen zur Abtötung von Krankheitserregern führen dann zu Kollateralschäden am umliegenden körpereigenen Gewebe.
„In dieser Studie haben wir deshalb mit der Frage begonnen, auf welche Weise das Schwarmverhalten zum Erliegen kommt, um eine unkontrollierte Anhäufung von Neutrophilen und eine übermäßige Entzündung zu verhindern. Fehlregulierte Immunreaktionen können zur Entstehung von degenerativen Krankheiten wie Krebs, Diabetes und Autoimmunerkrankungen beitragen,“ sagt Tim Lämmermann.
Molekulare Bremse der Neutrophilen gefunden
In früheren Studien haben er und sein Team die molekularen Mechanismen entdeckt, die das kollektive Schwarmverhalten auslösen. Jetzt berichtet seine Gruppe in Science, wie Neutrophile ihre Schwarmaktivität in bakteriell infiziertem Gewebe selbst begrenzen. Das ermöglicht bei der Beseitigung von Erregern eine optimale Balance zwischen Such- und Zerstörungsphasen.
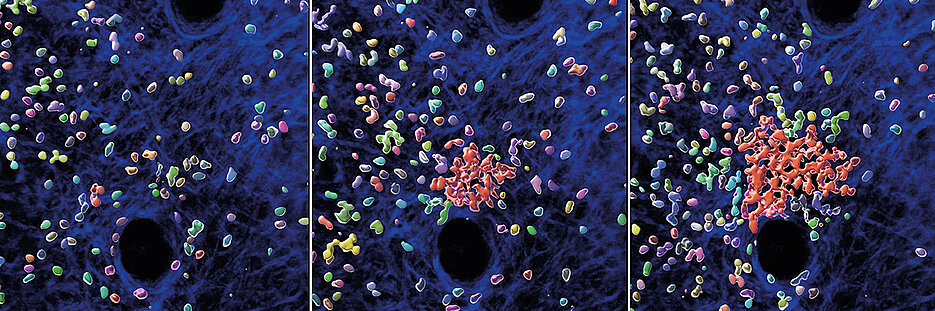
Mit speziellen Mikroskopen zur Echtzeit-Visualisierung der Immunzelldynamik in lebendem Mausgewebe zeigen die Forschenden: Schwärmende Neutrophile werden mit der Zeit unempfindlich gegenüber ihren eigenen Signalen, mit denen sie den Schwarm ursprünglich initiiert haben.
„Wir haben sozusagen die molekulare Bremse gefunden, mit der die Neutrophilen ihre Bewegung stoppen, sobald sie hohe Konzentrationen der sich anhäufenden Schwarmlockstoffe in Neutrophilen-Clustern wahrnehmen,“ erläutert Tim Lämmermann.
„Das war überraschend, denn die vorherrschende Meinung war eigentlich, dass externe Signale aus der Gewebeumgebung entscheidend sind, um die Neutrophilenaktivität in der Auflösungsphase einer Entzündung zu dämpfen“, sagt Professor Wolfgang Kastenmüller von der Max-Planck-Forschungsgruppe Systemimmunologie an der Julius-Maximilians-Universität (JMU) Würzburg. Er hat an der Studie mitgewirkt.
Internes Start-Stopp-System für optimale Keimbeseitigung
Angesichts des entdeckten Start-Stopp-Systems überprüften die Forschenden auch die gängigen Ansichten zu Bewegungsmustern und Jagdstrategien von Neutrophilen.
In Experimenten mit Neutrophilen, denen der Start-Stopp-Mechanismus fehlt, beobachtete das Team, dass diese Zellen viel schneller im Gewebe waren und somit sehr große Gewebebereiche nach Bakterien absuchen konnten.
Das verstärkte Schwarmverhalten machte diese Zellen jedoch nicht zu besseren Killern.
„Überraschenderweise war das Gegenteil der Fall. Neutrophile haben keinen Vorteil davon, sich besonders schnell im Gewebe zu bewegen und ohne Bremse wie verrückt umherzueilen. Stattdessen scheint es wesentlich vorteilhafter zu sein, wenn sie zusammenkommen, stehen bleiben und dann in der Gruppe eine schöne Bakterienmahlzeit genießen – auf diese Weise wird das bakterielle Wachstum viel besser im Gewebe eingedämmt,“ erklärt Tim Lämmermann.
Hoffnung auf neue therapeutische Ansätze
Die neuen Ergebnisse tragen klar zu einem besseren Verständnis der Biologie der Neutrophilen bei. Die Forschenden hoffen, dass ihre unerwarteten Erkenntnisse wichtige Impulse für neue therapeutische Ansätze bei krankhaften Entzündungszuständen liefern können.
Darüber hinaus könnten die beschriebenen Mechanismen des Schwarmverhaltens auch die Erforschung anderer Kategorien von kollektivem Verhalten und Selbstorganisation bei Zellverbänden oder Insekten bereichern.
Publikation
Neutrophils self-limit swarming to contain bacterial growth in vivo. Kienle K, Glaser KM, Eickhoff S, Mihlan, M, Knöpper K, Réategui E, Epple MW, Gunzer M, Baumeister R, Tarrant TK, Germain RN, Irimia D, Kastenmüller, W, Lämmermann T (17. Juni 2021), Science 372, DOI: 10.1126/science.abe7729