Mit Hemibodies das Multiple Myelom zielgenau bekämpfen
Uniklinikum Würzburg: In vitro und in vivo bewiesen: Der Einsatz von bestimmten Antigen-Fragment-Paaren – sogenannten Hemibodies – hat das Potenzial, das Multiple Myelom effektiv und hochspezifisch zu bekämpfen. Eine aktuelle Publikation des Uniklinikums Würzburg erläutert die Wirkungsweise und fasst den derzeitigen Entwicklungsstand der zukunftsträchtigen Immuntherapie zusammen.
Eine der Hürden bei der Therapie des Multiplen Myeloms ist die Unterscheidung zwischen den Tumor- und den gesunden Zellen des Körpers. Diese „Unschärfe“ kann bei der Behandlung von Patienten, die an dieser bösartigen Krebserkrankung des Knochenmarks leiden, drastische Folgen haben: Es kann zu teils schweren, unter Umständen auch lebensbedrohlichen Nebenwirkungen kommen. Zur Lösung dieser Misere arbeitet seit dem Jahr 2010 ein Team um die Würzburger Mediziner Prof. Dr. Gernot Stuhler und Dr. Thomas Bumm an einer Therapie mit Hemibodies, einer speziellen Kombination von Antigen-Fragmenten. Im Januar 2021 erschien in der Fachzeitschrift Communications Biology ein Beitrag, in dem Expert*innen der von Prof. Dr. Hermann Einsele geleiteten Medizinischen Klinik II des Uniklinikums Würzburg (UKW) die Funktionsweise von Hemibodies und die mit ihnen beim Multiplen Myelom bislang erreichten Erfolge darlegen.
Präzision durch Paare von Antigen-Fragmenten
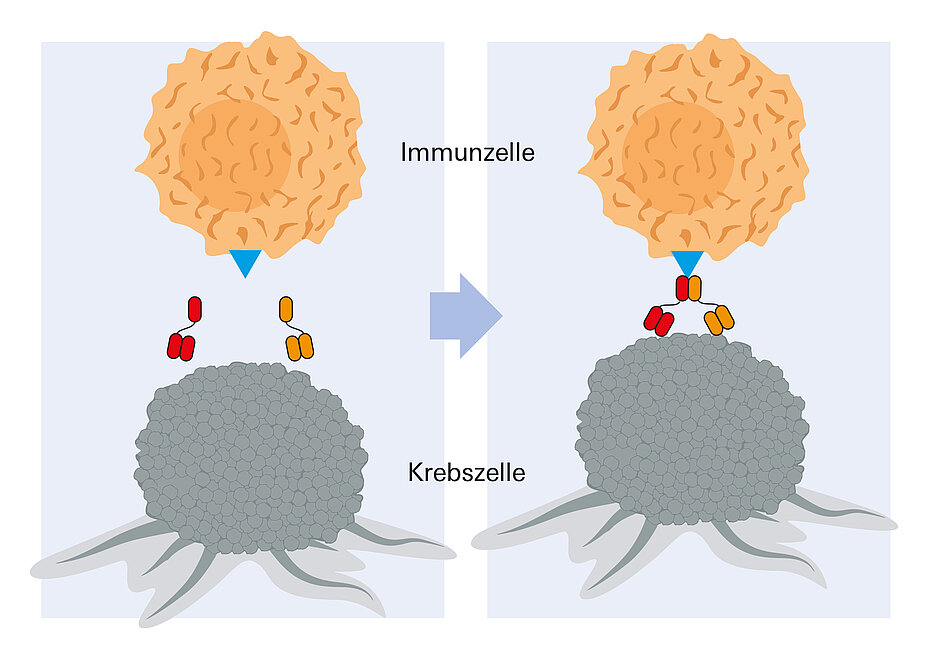
Im wahrsten Sinne des Wortes Ansatzpunkte des Verfahrens sind die Antigene SLAMF7 und CD38. Diese kommen beide häufig auf der Oberfläche von Myelom-Zellen vor. Jedes dieser „Targets“ für sich alleine genommen ist allerdings nicht sonderlich spezifisch, sie finden sich auch auf der Oberfläche anderer Zellen des Körpers. In Kombination sind sie jedoch hochspezifisch für die Tumorzellen. Bei der Hemibody-Technologie wird für jedes dieser Zielmoleküle ein gentechnisch maßgeschneidertes Antikörper-Fragment injiziert. Sie binden jeweils am passenden Ziel-Antigen und finden sich anschließend zu einem Paar mit dann immunstimulierenden Eigenschaften zusammen. Das bedeutet, dass sie zusammen in der Lage sind, T-Zellen auf der Oberfläche der Tumorzellen festzuhalten und zu aktivieren. Die Immunzellen können daraufhin die Krebszellen – und zwar nur diese – zerstören.
Nebenwirkungen werden zuverlässig vermieden
„Neben dem Beleg der Effizienz beim Kampf gegen die Myelom-Zellen konnten wir bislang im Reagenzglas und im Tiermodell beweisen, dass bei diesem Verfahren ungewollte Effekte, wie eine massive Zytokinfreisetzung und T-Zell-Brudermord-Reaktionen, zuverlässig vermieden werden können“, sagt Maria Geis, die Erstautorin der Publikation. Und Dr. Bumm ergänzt: „Unter dem Strich ist damit der Weg frei, Hemibodies zu einer effektiven und hochspezifischen Immuntherapie des Multiplen Myeloms weiterzuentwickeln.“
Literatur:
Geis, M., Nowotny, B., Bohn, MD. et al. Combinatorial targeting of multiple myeloma by complementing T cell engaging antibody fragments. Commun Biol 4, 44 (2021). https://doi.org/10.1038/s42003-020-01558-0