Kommandant im Produktionsraum der Zelle
Wie schaffen es Zellen, ihr Wachstum schnell an sich ändernde Umweltbedingungen anzupassen? Antwort auf diese Frage liefert eine neue Studie eines Würzburger Forschungsteams.
Egal, ob Einzeller oder Säugetier, Plankton oder Mammutbaum: Wachstum ist ein Grundprinzip jeglichen Lebens auf dieser Erde. Und Ausgangspunkt dieses Wachstums ist in der Regel die Zelle: Sie muss dafür innerhalb kurzer Zeit ihre Bestandteile und Inhaltsstoffe verdoppeln, damit sie sich anschließend teilen und das Wachstum in Gang setzen kann.
Der Prozess, der dahintersteht, ist vergleichsweise kompliziert und noch nicht bis ins letzte Detail entschlüsselt. Jetzt allerdings ist es einem Würzburger Forschungsteam gelungen, einen wesentlichen Mechanismus in diesem Geschehen zu identifizieren. Verantwortlich dafür sind die Professoren Utz Fischer vom Biozentrum der Julius-Maximilians-Universität Würzburg (JMU) und Jörg Vogel vom Würzburger Helmholtz-Institut für RNA-basierte Infektionsforschung (HIRI). In der neuesten Ausgabe der Fachzeitschrift Cell Reports stellen sie die Ergebnisse ihrer Arbeit vor.
Ribosomen liefern neue Proteine
„Damit Zellen wachsen können, müssen sie jede Menge neuer Proteine produzieren. Dies geschieht im Zellinneren in spezialisierten Fabriken, den sogenannten Ribosomen“, erklärt Utz Fischer, Inhaber des Lehrstuhls für Biochemie an der JMU. Bis zu zehn Millionen Ribosomen widmen sich in jeder menschlichen Zelle dieser Aufgabe. Dementsprechend wenden Zellen einen Großteil ihrer Ressourcen und Energiereserven nicht nur für die Herstellung von Proteinen, sondern vor allem auch für die Produktion und Instandhaltung der Ribosomen selbst auf. Man vermutet, dass hierfür bis zu 50 Prozent der zellulären Energiereserve benötigt wird, was die Ribosomen-Herstellung zum „teuersten“ Prozess in der Zelle macht.
Die Zelle kann es sich natürlich nicht leisten, solch große Mengen an Energie und Rohstoffen sinnlos zu verbrauchen. Deshalb überwacht sie kontinuierlich ihre Umgebung, um sicher zu gehen, dass jederzeit ausreichend Nährstoffe und andere Wachstumsstimuli verfügbar sind. Sobald sich die „Versorgungslage“ verschlechtert, hört sie auf zu wachsen und fährt die Produktion neuer Ribosomen herunter – hält aber trotz alledem einen ausreichend großen Nachschub an Ribosomen parat, um in besseren Zeiten ohne Verzögerung wieder wachsen zu können.
Ein Signalkomplex ist die zentrale Kommandostelle
Die zentrale Kommandostelle in diesem Prozess ist der sogenannte mTORC1-Signalkomplex, eine Art Nährstoffsensor der Zelle. „Alle Informationen zur Verfügbarkeit von Nährstoffen und anderen Wachstumsstimuli laufen an diesem Signalkomplex zusammen“, erklärt Dr. Cornelius Schneider, gemeinsamer Wissenschaftlicher Mitarbeiter der beiden Forschungslabors und Erstautor der jetzt veröffentlichten Studie.
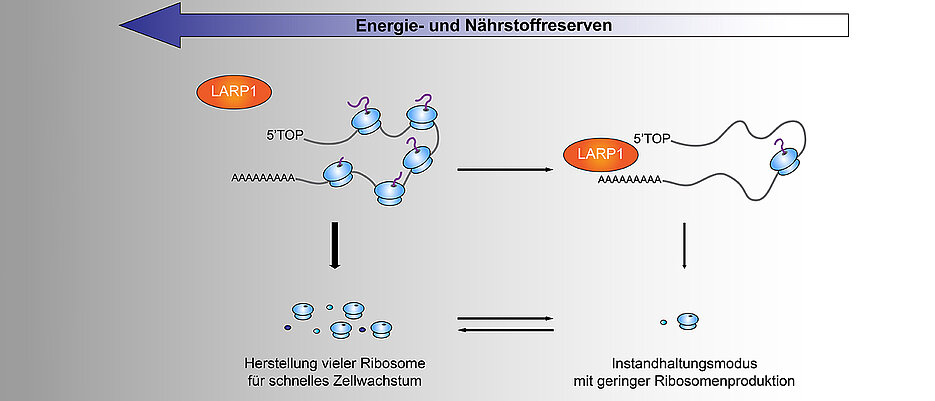
Auf der Basis dieser Informationen koordiniert mTORC1 die zelluläre Antwort auf sich ändernde Umgebungsbedingungen und kontrolliert die Produktion ribosomaler Proteine. Wie die Forscher zeigen konnten, bedient es sich dabei der Hilfe eines weiteren Proteins, das den wissenschaftlichen Namen LARP1 trägt. „mTORC1 kann das LARP1-Protein so beeinflussen, dass es unter Nährstoffmangel an eine Signalsequenz bindet, die sich am Anfang der mRNAs aller ribosomaler Proteine befindet. Hierdurch kommt es zu einer Reduzierung der Proteinproduktion“, erklärt Schneider. mRNAs sind, bildlich gesprochen, die Transporteure der Baupläne für Proteine aus dem Zellkern hin zu den Ribosomen.
Ein Grundvorrat bleibt immer erhalten
Die Produktion der ribosomalen Proteine wird zwar auf ein absolutes Minimum reduziert, ganz auf Null heruntergefahren wird sie jedoch zu keinem Zeitpunkt. „Somit kann die Zelle jederzeit wieder mit der Produktion großer Mengen an Ribosomen beginnen. Dies ermöglicht es ihr, extrem schnell auf sich ändernde Bedingungen zu reagieren und von Wachstum auf Energiesparen zu wechseln“, sagt Utz Fischer. Auf diese Weise ist es der Zelle möglich, auch unter schlechten Bedingungen immer einen gewissen Grundvorrat an mRNAs der ribosomalen Proteine zu erhalten.
Dazu passt auch ein weiterer Befund: LARP1 selbst und das Signalnetzwerk rund um mTORC1 sind in verschiedenen Krebsarten dereguliert, da sie im Zentrum der Entscheidung für oder gegen Zellwachstum stehen.
Originalpublikation
An unusual mode of baseline translation adjusts cellular protein synthesis capacity to metabolic needs. Cornelius Schneider, Florian Erhard, Beyenech Binotti, Alexander Buchberger, Jörg Vogel, Utz Fischer. Cell Reports, https://doi.org/10.1016/j.celrep.2022.111467
Kontakt
Prof. Dr. Utz Fischer, Lehrstuhl für Biochemie, Julius-Maximilians-Universität Würzburg,
T: +49 931 31-84029, utz.fischer@biozentrum.uni-wuerzburg.de