Forschung
Wir befassen uns mit der Zellbiologie von mesenchymalen Stromazellen (MSC) aus verschiedenen Geweben. MSC sind gewebespezifische Vorläuferzellen und wurden bereits in verschiedensten Geweben beschrieben. Sowohl aufgrund ihrer Fähigkeit in Zellen verschiedenster Linie (z.B. Adipozyten, Chondrozyten und Osteoblasten) zu differenzieren als auch durch ihre sekretorischen Eigenschaften, haben sie eine große Bedeutung in der Regenerativen Medizin. In unseren Projekten beleuchten wir die physiologischen und pathophysiologischen Interaktionen von MSC mit ihrer Umgebung. Durch ein besseres Verständnis dieser Wechselwirkungen sowie von Adaptionsmechanismen im Laufe der Degeneration von Geweben, können neue therapeutische Strategien abgeleitet werden.
Zurzeit bearbeiten wir folgende Themengebiete:
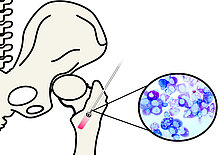
Neue therapeutische Strategien für die Rekonstruktion von Knochendefekten mittels Optimierung durch RIA-Technik gewonnener autologer Knochentransplante und Knochenersatzmaterialien - RIABONE
Sebastian Häusner, Bianca Schlierf, Theresa Kreuzahler, Marietta Herrmann
Kooperationspartner: Torsten Blunk (Würzburg), Aleksandra Jaukovic, Dusko Spasovski, Petar S. Milosavljević (alle Belgrad), OSARTIS GmbH
Der Einfluss inflammatorischer Faktoren auf MSC im Knochenmark und regenerative Prozesse
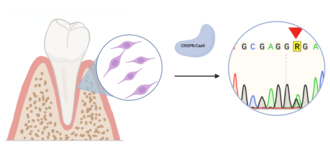
Die Auswirkung von Gendefekten auf MSC im Zahnhalteapparat
Katharina Marnet, Jana Schiffmaier, Theresa Kreuzahler, Drenka Trivanovic, Stephanie Graser (AG Hypophosphatasie Experimentell), Marietta Herrmann
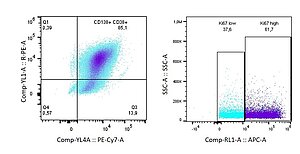
Tumor-MSC Wechselwirkungen
Jovana Ilic, Christoph Kölbl, Bianca Schlierf, Marietta Herrmann, Drenka Trivanovic
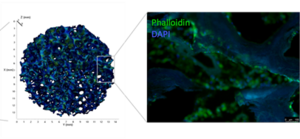
Die skelettale extrazelluläre Matrix und deren Einfluss auf MSC
Ana Rita Pereira, Drenka Trivanovic, Bianca Schlierf, Theresa Kreuzahler, Marietta Herrmann
Abgeschlossene Projekte:
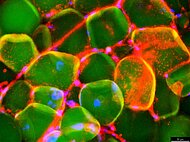
Identifikation und metabolische Charakterisierung von Vorläuferzellen des Knochenmark-Fettgewebes
Annika Schiminski, Christoph Kölbl, Bianca Schlierf, Marietta Herrmann, Drenka Trivanovic