Das Zimmermann-Labor interessiert sich für die dynamische Regulation von CD4-T-Zell-Antworten gegen kommensale Bakterien im Darm und auf anderen Schleimhautoberflächen. Zu diesem Zweck haben wir innovative gnotobiotische Ansätze entwickelt, wie zum Beispiel definierte, zeitlich und örtlich begrenzte Besiedlung keimfreier Mäuse. Diese ergänzen wir durch neu entwickelte immunologische Werkzeuge, wie etwa den adoptiven Transfer spezifischer CD4-T-Zellen und Peptid:MHC-Tetramere, aber auch durch klassische Assays, wie Multiparameter-Durchflusszytometrie, Immunfluoreszenzmikroskopie und scRNA-seq. Unser Ziel ist es, zu verstehen, wie solche durch die Mikrobiota induzierte CD4-T-Zellen zum Schutz von Schleimhautbarrieren beitragen, aber bei Fehlregulation auch chronisch-entzündliche Darmerkrankungen (IBD von englisch inflammatory bowel disease) antreiben können. Wir hoffen, dass unsere Arbeit mukosale Impfansätze verbessern und neue therapeutische Ziele für IBD identifizieren kann. Um diagnostische Möglichkeiten zu erweitern, entwickelt die Gruppe auch neue Sequenzierungs- und Zytometrie-basierte Methoden der Mikrobiotaanalyse.
Wir sind ein junges & enthusiastisches Team mit einem Faible für technisch-innovative Ansätze für die offenen Fragen in unserem Fachgebiet und schätzen Neugier, Vielfalt und Zusammenarbeit.
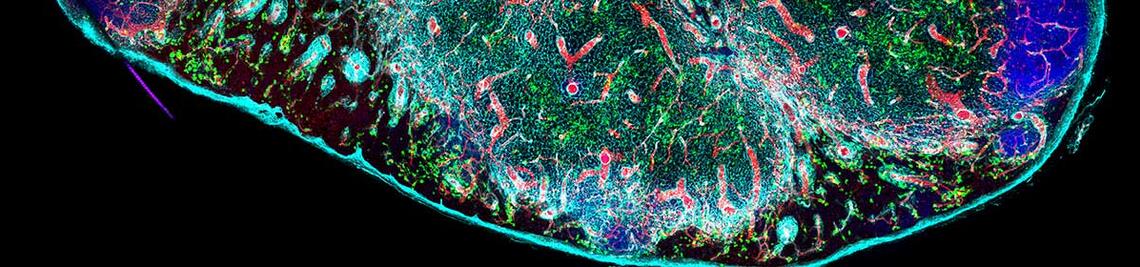
Mikrobiota-spezifisches CD4-T-Zell-Gedächtnis
Der menschliche Darm beheimatet die dichteste Ansammlung von Mikroorganismen auf der Erde – die Darmmikrobiota. In den letzten zwei Jahrzehnten wurde gezeigt, dass unser Immunsystem aktiv mit diesen überwiegend nützlichen Bewohnern interagiert. Helfer-T-Zellen sind wichtige Immunzellen, die durch die Darmmikrobiota induziert werden und eine entscheidende Rolle für das Gleichgewicht zwischen Immunsystem und Darmbakterien spielen. Während sie unter normalen Umständen wichtig für den Schutz der Barriere sind, können fehlregulierte Mikrobiota-spefizische Helfer-T-Zellen auch chronische Entzündungen verursachen, wie bei chronisch-entzündlichen Darmerkrankungen (IBD von engl. Inflammatory bowel disease). Trotz entscheidender Erkenntnisse in den vergangenen Jahren, ist bislang unklar, ob das menschliche Immunsystem ein T-Zell-Gedächtnis gegen die Darmmikrobiota aufbaut – ähnlich wie es von Impfungen oder Infekten bekannt ist. Wir sind überzeugt, dass ein besseres Verständnis des Mikrobiota-spezifischen T-Zell-Gedächtnisses entscheidend sein könnte, um bessere mukosale Immunisierungen zu entwickeln und plötzliche Krankheitsrückfälle bei IBD zu verhindern.
In diesem von einem ERC Starting Grant finanzierten Projekt kombinieren wir neu entwickelte Modelle der vorübergehenden Besiedlung keimfreier Mäuse durch prototypische Darmkommensale mit hochmodernen immunologischen Werkzeugen, um zu verstehen, wie nicht-pathogene Darmbakterien langlebige, im Gewebe ansässige T-Helfer-Gedächtniszellen induzieren. Unsere Hauptfragen sind: (1) wie solche Th-Zellen im Gewebe erhalten und reguliert werden, (2) wie ihr Phänotyp während der Induktion und bei Reaktivierung von Wirts- sowie mikrobiellen Faktoren geprägt wird und (3) welche physiologische Bedeutung sie für die Schleimhautfunktion, den Barriereschutz und die Kontrolle der Bakterien im Darmlumen haben. Insgesamt soll dieses Projekt die Regulation mikrobiota-spezifischer Gedächtnis-T-Helfer-Zellen aufklären, um letztendlich das Design mukosaler Impfstoffe zu verbessern und die selektive Depletion derjenigen T-Zellen zu ermöglichen, die massgeblich chronisch-entzündliche Darmerkrankungen antreiben.
Publikationen (Auswahl)
Gesamtliste: https://scholar.google.ch/citations?user=bOsu0sEAAAAJ&hl=en
F. Schmidt*, J. Zimmermann*, T. Tanna*, R. Farouni, T. Conway, A. J. Macpherson*, R. J. Platt*, Noninvasive assessment of gut function using transcriptional recording sentinel cells. Science 376, eabm6038 (2022). *equal contribution
C. Stehle, T. Rückert, R. Fiancette, D. W. Gajdasik, C. Willis, C. Ulbricht, P. Durek, M.-F. Mashreghi, D. Finke, A. E. Hauser, D. R. Withers, H.-D. Chang, J. Zimmermann*, C. Romagnani*, T-bet and RORα control lymph node formation by regulating embryonic innate lymphoid cell differentiation. Nat Immunol 22, 1231–1244 (2021). *equal contribution
B. Yilmaz*, C. Mooser*, I. Keller*, H. Li, J. Zimmermann, L. Bosshard, T. Fuhrer, M. G. de Agüero, N. F. Trigo, H. Tschanz-Lischer, J. P. Limenitakis, W.-D. Hardt, K. D. McCoy, B. Stecher, L. Excoffier, U. Sauer, S. C. Ganal-Vonarburg, A. J. Macpherson, Long-term evolution and short-term adaptation of microbiota strains and sub-strains in mice. Cell Host Microbe 29, 650-663.e9 (2021). *equal contribution
K. Gronke*, P. P. Hernández*, J. Zimmermann, C. S. N. Klose, M. Kofoed-Branzk, F. Guendel, M. Witkowski, C. Tizian, L. Amann, F. Schumacher, H. Glatt, A. Triantafyllopoulou, A. Diefenbach, Interleukin-22 protects intestinal stem cells against genotoxic stress. Nature 566, 249–253 (2019). *equal contribution
J. Zimmermann, P. Durek, A. A. Kühl, F. Schattenberg, P. Maschmeyer, F. Siracusa, K. Lehmann, K. Westendorf, M. Weber, R. Riedel, S. Müller, A. Radbruch, H. Chang, The intestinal microbiota determines the colitis-inducing potential of T-bet-deficient Th cells in mice. Eur. J. Immunol. 48, 161–167 (2017).
J. Zimmermann*, T. Hübschmann*, F. Schattenberg, J. Schumann, P. Durek, R. Riedel, M. Friedrich, R. Glauben, B. Siegmund, A. Radbruch, S. Müller, H. Chang, High-resolution microbiota flow cytometry reveals dynamic colitis-associated changes in fecal bacterial composition. Eur. J. Immunol. 46, 1300–1303 (2016). *equal contribution
J. Zimmermann, A. A. Kühl, M. Weber, J. R. Grün, J. Löffler, C. Haftmann, R. Riedel, P. Maschmeyer, K. Lehmann, K. Westendorf, M.-F. Mashreghi, M. Löhning, M. Mack, A. Radbruch, H. D. Chang, T-bet expression by Th cells promotes type 1 inflammation but is dispensable for colitis. Mucosal Immunol 9, 1487–1499 (2016).
J. Zimmermann, A. Radbruch, H. Chang, A Ca2+ concentration of 1.5 mM, as present in IMDM but not in RPMI, is critical for maximal response of Th cells to PMA/ionomycin. Eur. J. Immunol. 45, 1270–1273 (2015).