Nobelpreis für Immunologie: Wie diese Pionierarbeit unsere Forschung prägt
16.10.2025Die Entdeckung der regulatorischen T-Zellen hat die Immunologie revolutioniert. Unsere Teams forschen an Stoffwechsel und Funktion dieser Immunzellen.
Die Entdeckung der sogenannten regulatorischen T-Zellen (Tregs) markiert einen echten Meilenstein in der Immunologie. Sie hat unser Verständnis davon, wie der Körper sich selbst schützt und reguliert, grundlegend verändert. Die Max-Planck-Forschungsgruppe für Systemimmunologie und der Lehrstuhl für Systemimmunologie an der Uni Würzburg erforschen, wie der zelluläre Stoffwechsel die Funktion von Tregs steuert, welche Rolle gewebsresidente Tregs in verschiedenen Organen spielen und wie Darm-Tregs das Immungleichgewicht und Entzündungen kontrollieren.
Shimon Sakaguchi und die Entdeckung der regulatorischen T-Zellen
Bereits in den 1970er-Jahren wurden sogenannte Suppressor Cells intensiv erforscht. Doch das Feld blieb lange Zeit ohne klare Fortschritte. Viele Experimente führten ins Leere, und das Thema galt als wenig angesehen. Erst Mitte der 1990er-Jahre brachte Shimon Sakaguchi neuen Schwung in die Forschung und machte das Gebiet wieder populär. Sein erstes Schlüsselpaper erschien im Journal of Immunology, also in keinem der High Impact Journals, der Inhalt aber war bahnbrechend: Sakaguchi konnte erstmals überzeugend zeigen, dass eine kleine Untergruppe von CD4⁺-Helfer-T-Zellen eine immunsuppressive Wirkung besitzt.
Ebenso bedeutsam war die Leistung von Mary Brunkow und Fred Ramsdell, die das defekte Gen in den sogenannten Scurfy-Mäusen identifizieren konnten. Die Sequenzierung eines so großen Gen-Lokus war damals eine enorme technische Herausforderung. Das identifizierte Gen, Foxp3, war bis dahin unbekannt - und stellte sich als unverzichtbar für die Entwicklung und die regulatorische Funktion dieser speziellen T-Zellen heraus. Brunkow und Ramsdell erkannten zudem, dass auch die X-chromosomal vererbte Autoimmunkrankheit IPEX durch Mutationen in diesem Gen verursacht wird.
Zwei Jahre später gelang es Sakaguchi, diese Entdeckungen mit seinen Beobachtungen zu verknüpfen. Er konnte zeigen, dass das Foxp3-Gen die Entwicklung jener Zellen steuert, die er bereits 1995 identifiziert hatte. So ergänzten sich die Arbeiten von Sakaguchi (zelluläre Ebene) und Brunkow/Ramsdell (genetische Ebene) perfekt und führten zu einer völlig neuen Sichtweise darauf, wie das Immunsystem funktioniert und sich selbst reguliert.
Wie so oft in der Wissenschaft ist unser heutiges Verständnis von Tregs jedoch nicht nur das Ergebnis der Arbeit dieser drei Pioniere – auch wenn ihre Beiträge entscheidend waren. Nachdem durch Sakaguchis Entdeckungen klar wurde, dass Tregs tatsächlich existieren und sich anhand des Transkriptionsfaktors Foxp3 eindeutig identifizieren lassen, widmete sich eine ganze Generation von Immunologinnen und Immunologen der Erforschung dieser Zellen.
Neben den Preisträgern haben zahlreiche Forschende, darunter etwa Alexander Rudensky, Jeff Bluestone, Ethan Shevach und viele andere, das Feld maßgeblich geprägt. So entstand eines der spannendsten Forschungsgebiete der modernen Immunologie. Und unser Verständnis des Immunsystems hat sich dadurch grundlegend erweitert.
Tregs: Metabolismus und Immunregulation
Tregs unterscheiden sich von anderen T-Zellen nicht nur durch ihre Aufgaben im Immunsystem, sondern auch durch ihren speziellen Stoffwechsel. In den letzten Jahren hat sich gezeigt, dass dieser einzigartige Energiestoffwechsel entscheidend für die Entwicklung der Tregs und für die Wirksamkeit ihrer regulierenden Funktionen ist.
Tregs sind an nahezu allen entzündlichen Prozessen beteiligt. Darüber hinaus spielen sie eine wichtige Rolle bei der Aufrechterhaltung der Gewebehomöostase, bei der Tumorentstehung anderen „toleranten“ Situationen, wie etwa bei der Schwangerschaft oder bei Organtransplantationen.
Die Gruppe von Martin Vaeth an der Max-Planck-Forschungsgruppe untersucht, wie Tregs auf molekularer und metabolischer Ebene reguliert werden - und welche Anpassungen die Funktionen von Tregs im Gewebe steuern. Die Gruppe will herausfinden, ob man diese Anpassungen gezielt manipulieren kann, beispielsweise. zur Behandlung von Autoimmunkrankheiten oder Krebs.
„Als ich als in der Wissenschaft angefangen habe wurden gerade die ersten genetischen Modelle und andere Werkzeuge zur Erforschung von Tregs entwickelt - mit einigen davon arbeitet mein Labor noch heute. Insofern freut mich der Preis für diese Leistung auch ganz persönlich, denn diese Zellen haben meine bisherige Laufbahn entscheidend geprägt und sind einfach faszinierend,“ so der Forscher.
Die Bedeutung von Foxp3 in Tregs
Die Entdeckung, dass Foxp3 ein wesentlicher und spezifischer Transkriptionsfaktor von Tregs ist, stellt einen entscheidenden Fortschritt für unsere Forschung dar. Dieses Wissen ist von zentraler Bedeutung, da es sowohl die Identifikation von Tregs als auch deren gezielte genetische Manipulation und Depletion ermöglicht.
„Trotz dieser wichtigen Erkenntnis ist bis heute nicht vollständig verstanden, wie Tregs im Detail funktionieren. Es existieren zahlreiche vorgeschlagene Mechanismen, die ihre immunsuppressiven Funktionen erklären sollen, doch bislang gibt es keinen einheitlichen Konsens darüber, wie Tregs verschiedene Immunantworten tatsächlich unterdrücken“, beschreibt Wolfgang Kastenmüller, Leiter der Max-Planck-Forschungsgruppe für Systemimmunologie.
Um diese offenen Fragen zu klären, nutzt seine Gruppe verschiedene Tiermodelle, die auf Foxp3 basieren. Dazu gehören fluoreszente Reporterlinien zur Visualisierung von Tregs, und transgene Linien zur gezielten genetischen Manipulation sowie zur spezifischen Depletion dieser Zellen. Diese Modelle sind essenziell, um die Funktion und Bedeutung von Tregs in unterschiedlichen immunologischen Kontexten besser zu verstehen.
In ihrer Publikation in Science 2025 (Jobin et al.) haben die Forschungsgruppen um Wolfgang Kastenmüller und Georg Gasteiger die Funktion der Tregs während einer antiviralen Immunantwort untersucht. Tregs unterdrücken dabei andere Immunzellen, zum Beispiel CD8+ T-Zellen, indem sie um das IL-2 von den CD4⁺ T-Helferzellen konkurrieren.
Die Gruppen untersuchen außerdem, wie Tregs sich in verschiedenen Geweben entwickeln und welche Aufgaben die einzelnen Untergruppen dieser Zellen haben, um besser zu verstehen, wie Tregs im Körper wirken.
Gewebsresidente Tregs in Organen
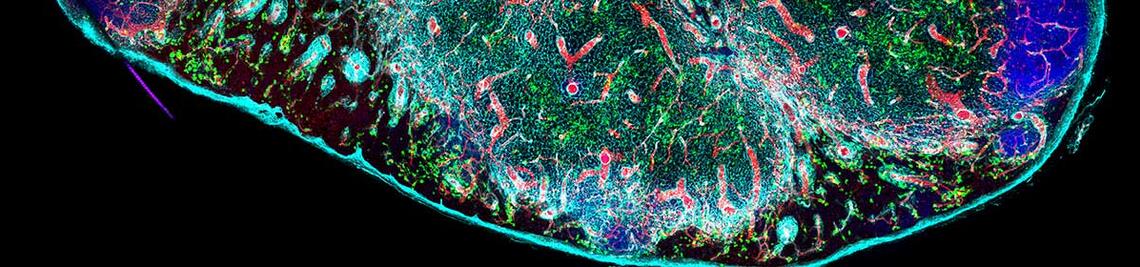
Fast alle Organe beherbergen gewebsresidente Lymphozyten, darunter auch Tregs, die an vorderster Front zur Immunüberwachung beitragen. Die Tregs interagieren mit anderen Immun- und Gewebezellen, fördern die Gewebehomöostase und unterstützen Reparaturprozesse. Ihre strategische Positionierung in verschiedenen Organen macht sie entscheidend für die Balance zwischen effektiver Abwehr, Gewebeintegrität und der Kontrolle von Entzündungen oder Autoimmunreaktionen.
Die Gruppe um Georg Gasteiger, Leiter der Max-Planck-Forschungsgruppe für Systemimmunologie, untersucht, wie sich diese lokalen Lymphozytennetzwerke in den verschiedenen Geweben bilden, wie Tregs und andere Immunzellen miteinander interagieren und welche organspezifischen Funktionen sie übernehmen – sowohl unter physiologischen Bedingungen als auch während Infektionen oder Entzündungen.
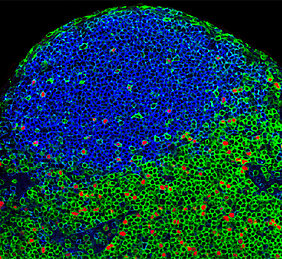
Regulatorische T-Zellen im Darm
Die Gruppe um Jakob Zimmermann vom Institut für Systemimmunologie an der Universität Würzburg untersucht, wie T-Zellen und das Darmmikrobiom zusammenarbeiten und welche Rolle sie bei chronisch-entzündlichen Erkrankungen spielen. Besonders wichtig sind dabei die regulatorischen T-Zellen, die Entzündungen stoppen und das Immungleichgewicht im Darm kontrollieren.
Die Forschung der vergangenen Jahre zeigt, dass diese T-Zellen bereits rund um die Still-Entwöhnung von Babys entstehen, wenn sich die Mikrobiota durch die neue Ernährung stark diversifiziert. Diese frühen regulatorischen T-Zellen sind entscheidend, um auch im Erwachsenenalter Immunpathologien, die durch die Mikrobiota ausgelöst werden, zu verhindern.
„Wir erforschen, wie die Bakterien der komplexen (Darm-) Mikrobiota die Differenzierung von T-Zell-Subtypen beeinflusst, welche jeweils entzündungsfördernd oder entzündungshemmend – wie die im Nobelpreis besprochenen regulatorischen T-Zellen – sein können. Einige fördern Entzündungen, andere bremsen sie. Dabei schauen wir auf Bakteriendosis, Dauer der Exposition, Ernährung und den Reifegrad des Immunsystems“, so der Gruppenleiter. „Die Funktion der Tregs beruht unter anderem auf inhibitorischen Molekülen wie CTLA-4, über deren Bedeutung ich 2022 auf der Jahrestagung der DGfI in Hannover von Shimon Sakaguchi persönlich hören konnte.“
Das Ziel der Zimmermann Labs ist es, die Förderung regulatorischer T-Zellen zu verbessern, um chronisch-entzündliche Darmerkrankungen zu verhindern. Das Team untersucht, wie ihre Lebensdauer durch das Immunsystem und die Mikrobiota beeinflusst wird und wie dieses Wissen für therapeutische Ansätze genutzt werden kann.
Arbeiten zu Tregs unserer Wissenschaftlerinnen und Wissenschaftler
M. Vaeth et al. Regulatory T cells facilitate the nuclear accumulation of inducible cAMP early repressor (ICER) and suppress nuclear factor of activated T cell c1 (NFATc1), Proc. Natl. Acad. Sci. U.S.A. 108 (6) 2480-2485, https://doi.org/10.1073/pnas.1009463108 (2011).
M. Vaeth et al. Dependence on nuclear factor of activated T-cells (NFAT) levels discriminates conventional T cells from Foxp3+ regulatory T cells, Proc. Natl. Acad. Sci. U.S.A. 109 (40) 16258-16263, https://doi.org/10.1073/pnas.1203870109 (2012).
Martin Vaeth et al. Follicular regulatory T cells control humoral autoimmunity via NFAT2-regulated CXCR5 expression. J Exp Med (2014) 211 (3): 545–561. https://doi.org/10.1084/jem.20130604
Vaeth, M., Wang, YH., Eckstein, M. et al. Tissue resident and follicular Treg cell differentiation is regulated by CRAC channels. Nat Commun 10, 1183 (2019). https://doi.org/10.1038/s41467-019-08959-8
Katarzyna Jobin et al, A distinct priming phase regulates CD8 T cell immunity by orchestrating paracrine IL-2signals. Science388, eadq1405(2025). DOI:10.1126/science.adq1405
Kaminski A, Hager FT, Kopplin L, Ticconi F, Leufgen A, Vendelova E, Rüttger L, Gasteiger G, Cerovic V, Kastenmüller W, Pabst O, Ugur M. Resident regulatory T cells reflect the immune history of individual lymph nodes. Sci Immunol. 2023 Nov 24;8(89):eadj5789. doi: 10.1126/sciimmunol.adj5789