Arbeitsgruppe Streckfuß-Bömeke
Präzisionsmedizin and Kardiotoxizität
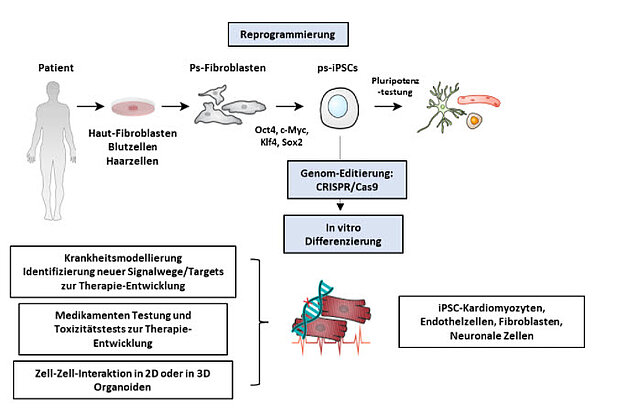
Der Fokus unserer Arbeitsgruppe liegt auf der Erforschung von Herzerkrankungen mit Schwerpunkt Kardiomyopathien, das kardiotoxische Screening von Arzneistoffen/Medikamenten in verschiedenen Herzzellen und Geweben und die Entwicklung neuer therapeutischer Ansätze auf Patienten-spezifischer Ebene. Das können wir gerichtet in einem humanen Patienten-spezifischen Zellkultur System untersuchen, dem sogenannten „patient in a dish“-System. Dafür werden gewöhnliche Körperzellen eines Patienten/Individuums (Hautzellen, Blutzellen, Haarzellen) mit spezifischen Transkriptionsfaktoren behandelt und diese so in Patienten-spezifische induzierte pluripotente Stammzellen (ps-iPSC) reprogrammiert. Die so erhaltenen ps-iPSC haben die Fähigkeit, in spezialisierte Körperzellen (z.B. Herzzellen, Nervenzellen, Hepatozyten, Muskelzellen) zu differenzieren, was wir uns in verschiedenen Gebieten im Bereich der Grundlagenforschung zunutze machen. Da die ps-iPSC den kompletten genetischen Hintergrund eines Patienten mitbringen, können die differenzierten Herzmuskelzellen im Kontext des Patienten-spezifischen Krankheitsbildes untersucht werden. Zusätzlich dazu erlauben Gen-Editierungsmethoden wie die CRISPR/Cas9-Technologie punktuell genetische Informationen zu modifizieren, um so z.B. eine pathogene Mutation zu beheben oder diese isoliert im gesunden genetischen Hintergrund zu untersuchen.
Allerdings spielen nicht nur die Herzzellen bei den Herzerkrankungen eine Rolle, sondern auch die Interaktion der Herzzellen mit anderen Zellen und Organe, z.B. ist die Herz-Hirn Verbindung bei der Entstehung des sogenannten Takotsubo Symdroms von großer Bedeutung. Auch der ‚Crosstalk‘ von atrialen oder ventrikulären Herzzellen mit Endothelzellen oder kardialen Fibroblasten spielt bei der Entstehung verschiedener Kardiomyopathien eine Rolle. Diese Interaktionen untersuchen wir, indem wir die ps-iPSC gerichtet in Zielzellen differenzieren (Endothel, Fibroblasten, dopaminerge Neurone, Leberzellen, Nierenzellen, o.a.) und z.B. als Ko-Kultur oder in 3D Organoiden zusammenbringen.
Das Ziel dieser Projekte ist es, molekulare Ursachen und deren physiologische Konsequenz von Herzkrankheiten aufzudecken und im Bereich der personalisierten Medizin eine optimale Medikamententherapie an dem „patient in a dish“ zu testen, die anschließend Patienten-spezifisch angewendet werden soll.
Wir konnten in früheren Arbeiten zeigen, dass die Reprogrammierung sowie die kardiale Differenzierung von der somatischen Zellquelle abhängen. Mesenchymale Stammzellen und Fibroblasten aus der Haut lassen sich effektiver reprogrammieren und in iPSC-Kardiomyozyten differenzieren als Blutzellen der jeweiligen Patienten. Funktionelle Untersuchungen zeigten allerdings, dass die generierten iPSC-Kardiomyozyten in ihrer Funktion sehr ähnlich sind-unabhängig von der somatischen Zellquelle (Streckfuß-Bömeke et al., 2013, EHJ; Hübscher et al., 2019, Cell Reprogramming). Allerdings spielt der Reifegrad der generierten iPSC-Kardiomyozyten eine große Rolle bei funktionellen Untersuchungen. Wir interessieren uns für die Reifungsprozesse von hergestellten iPSC-Kardiomyozyten und konnten kürzlich zeigen, dass die längere Kultivierung von bis zu 12 Wochen einen großen Einfluss auf den Energie-Metabolismus in iPSC-Kardiomyozyten hat (Emanuelli et al., 2021; JMCC). Wir untersuchen somit zum einen die Reprogrammierungsprozesse unterschiedlicher somatischer Zellen in iPSCs sowie die Modulation der Kardiomyozyten Reifung in vitro, um die iPSC-Kardiomyozyten in einen Zustand zu bekommen, der humanen adulten Herzzellen möglichst ähnlich ist.
Ein Kernbereich unserer Arbeiten ist die Untersuchung von molekularen und funktionellen Mechanismen von Herzinsuffizienz, Arrhythmie und Gefäßerkrankungen mittels Patienten-spezifischer iPSC sowie primär isolierter Zellen aus Myokardproben. Wir konnten ps-iPSCs von über 100 Patienten mit Kardiomyopathien, Arrhythmien oder vaskulären Erkrankungen generieren (familiäre genetisch-bedingte kardiovaskuläre Erkrankungen (Dilatative Kardiomyopathie, Non-compaction linksventrikuläre Kardiomyopathie, Mitochondrial-bedingte Kardiomyopathien) sowie kardiovaskuläre Erkrankungen mit bislang nicht eindeutiger genetischer Ursache (Takotsubo-Syndrom (TTS), Anthrazyklin-induzierte Kardiomyopathie (ACT), Arrhythmie-induzierte Kardiomyopathie (AIC)). Die iPSCs von den betroffenen kardiovaskulären Patienten und gesunden Familienkontrollen können in iPSC-Kardiomyozyten (iPSC-KMs) differenziert werden und diese bezüglich ihres kardialen/vaskulären Phänotyps untersucht werden. Dabei fokussieren wir uns unter anderem auf wichtige kardiale Signalwege wie den β-adrenergen Signalweg oder einzelne sekundäre Messenger-Moleküle (cyclisches cAMP) oder Proteine (Phosphodiesterasen).
Ziel dieser Studien ist es herauszufinden, welche Mechanismen allgemeine Pathomechnismen darstellen und welche Patienten-spezifisch auftreten und so individuelle Behandlungsstrategien benötigen.
Beispiele Disease Modeling:
-Untersuchung von Patienten mit diastolischer Dysfunktion und Defekten im Splicingfaktor RBM20 mittels Patienten-spezifischer iPSCs (Streckfuß-Bömeke et al., 2017 (JMCC), Rebs et al., 2020 (SCR), 2022 (STAR. Prot))
-Etablierung eines Patienten-spezifischen Takotsubo-Syndrom (TTS) Stammzellmodells (Borchert et al., 2017, JACC)
-Mechanismen und genetische Polymorphismen für die Entstehung einer Anthrazyklin-induzierten Herzinsuffizienz mittels Patienten-spezifischer Kardiomyozyten (Haupt et al., 2022, Basic Research in Cardiology)
Disease Modelling von kardiovaskulären Erkrankungen auf Patienten-spezifischer Ebene: Verschiedene somatische Zelltypen vom Patienten können mittels Überexpression der Pluripotenzfaktoren OCT4, SOX2, KLF4 und c-MYC zu patientenspezifischen pluripotenten Stammzellen reprogrammiert werden. Die generierten iPS-Zellen können über CRISPR/Cas9 Genom-editiert und in diverse Zelltypen differenziert werden. und ermöglichen die Krankheitsmodellierung in vitro, Medikamenten-Screenings, Toxizitätstest sowie Zell-Zell-Interaktionsstudien.
Um neue Therapiestrategien zu identifizieren, nutzen wir zum einen die Ergebnisse unserer Genotyp-Phänotyp-Analysen und zum anderen die pathomechanistischen Erkenntnisse des Disease-Modellings. Somit verfolgen wir ich z.B. aufgrund experimenteller Befunde die therapeutische Korrektur (CRISPR/Cas9) von identifizierten Krankheits-auslösenden Mutationen (z.B. in RBM20, FLNC, LMNA, TTN, PRDM16, ILK2) bei Dilatativer Kardiomyopathie (DCM), RBM20 bei linksventrikulärer Non-Compaction Kardiomyopathie (LVNC) oder SCN5A, SCN10A, KCNQ1 bei Arrhythmie-assoziierten Erkrankungen. Darüber hinaus fokussieren wir uns z.B. auf die pharmakologische Inhibition von β-adrenergen Rezeptoren als Takotsubo-Syndrom (TTS)-Therapie bzw. die pharmakologische Inhibition neuronaler Natriumkanäle (Nav1.8) als anti-arrhythmisches Therapiekonzept. So konnten wir kürzlich zeigen, dass der neuronale Natriumkanal Nav1.8 auch in Kardiomyozyten exprimiert wird und in Herzerkrankungen wie Hypertrophie und Heart failure hochreguliert wird. Die genetische Modulation des Nav1.8 mittels der CRISPR/Cas9 Technologie lieferte den endgültigen Beweis, dass Nav1.8 an Arhythmien und einer erhöhten Sterblichkeit in Mäusen und Stammzellen beteiligt ist (Bengel et al., 2021, Nat. commun.).
A: Derzeit werden 30% aller Arzneimittel, die in in vivo Tiermodellen und klinischen Studien getestet worden sind, vom Markt genommen, da toxische Nebenwirkungen auftreten. So kommt es bei der Einnahme von Anthrazyklinen (Medikamente gegen Krebserkrankungen) häufig zu kardiotoxischen Nebenwirkungen, die die Leistung des Herzens verringern. Somit dienen ps-iPSC-Kardiomyozyten (oder andere iPSC-Derivate in 2D) sowie 3D- Organoide als in vitro Zellmodell, um kardiotoxische Substanzen zu identifizieren und alternative Strukturen zu generieren. So konnten in unserer Arbeitsgruppe in der Vergangenheit neue Pathomechanismen identifiziert werden, die bei B-Zell-Lymphom-Patienten nach Antrhrazyklin-Behandlung zur Entstehung einer Kardiomyopathie geführt haben (Haupt et al., 2022, Basic Research in Cardiology).
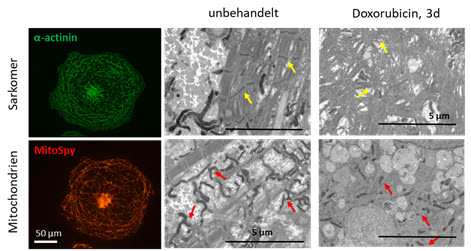
Generierte iPSC-Kardiomyozyten von B-Zell-Lymphom-Patienten mit anschließender Kardiomyopathie-Entwicklung. Mittels Immunfluoreszenz-Färbungen (links) und Elektronenmikroskopie (rechts) sind die Sarkomere und das mitochondriale Netzwerk von iPSC-Kardiomyozyten dargestellt. Rechts: Einfluss von Doxorubicin auf diese Strukturen (modifiziert aus Haupt et al., 2022).
B: Des Weiteren testen wir basierend auf grundlagenwissenschaftlichen Ergebnissen (bench to bed) sowie auf (retrospektiven und prospektiven) klinischen Studien (bedside back to bench) die spezifische Wirkung bestimmter Medikamente im in vitro ps-iPSC-KM (oder anderer iPSC-Derivate) System. Der große Vorteil der iPSC-KMs gegenüber isolierten humanen Primärkulturen liegt darin, dass erstmals ein humanes in vitro Kardiomyozyten-System vorliegt, mit dem chronische (Wochen bis Monate) Behandlungen getestet und analysiert werden können. So konnte unsere Arbeitsgruppe in der Vergangenheit verschiedene in der Klinik bereits zugelassene Medikamente wie das Empagliflozin und deren spezifische Wirkung auf isolierte iPSC-Kardiomyozyten testen.