BMBF Konsortium Osteopath
Im Rahmen der Ausschreibungen des BMBF zu Forschung über Muskuloskelettale Erkrankungen und Verletzungen hat ein neues Projekt mit Beteiligung des Orthopädischen Centrums für Muskuloskelettale Forschung begonnen. Das Projekt beschäftigt sich unter der Bezeichnung „Osteopath“ mit der Molekularen Pathologie der Osteoporose. Der Organisator des Projekts ist Prof. Dr. Stefan Mundlos, Institut für medizinische Genetik der Charité in Berlin, und Direktor des Max-Planck-Institutes für medizinische Genetik in Berlin. Das Projekt fokussiert auf den Osteozyten und seine zellbiologische Regulation, sowie die Regulation der lokalen Mineralisierungsvorgänge. Im Folgenden finden Sie eine Kurzzusammenfassung des Würzburger Projekts, das von Frau Dr. Birgit Mentrup verantwortlich betreut wird. Es ist eingebunden in die Gruppe Stammzellbiologie des Orthopädischen Zentrums unter der Leitung von Frau Dr. Regina Ebert und Prof. Franz Jakob.
Titel des Teilprojekts
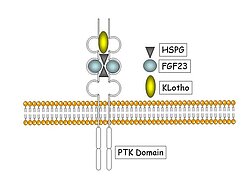
Die Rolle von FGF23 bei der Regulation der Transition vom Osteoblasten zum Osteozyten und des lokalen Kalzium / Phosphat-Stoffwechsels
MitarbeiterInnen
Birgit Mentrup
Regina Ebert
Ulrich Goschenhofer
Christine Hofmann
Franz Jakob
Dieses Teilprojekt konzentriert sich auf die Funktion von FGF23 in der Mineralisierung und auf die Rolle von FGF23 während des Alterungsprozesses in humanen Osteozyten in Miniorgankulturen. Das Ziel ist der Aufbau eines 3D-Osteozyten Differenzierungssystems, um lokal die Regulation von FGF23 untersuchen zu können. Weiterhin sollen die Funktion von FGF23/Klotho bei der Osteozytenalterung aufgeklärt werden. Hier eingesetzte Techniken sind die FGF23 Überexpression bzw. der FGF23 Knockdown und die Analyse des FGF23 Effektes via FGFR1 auf die Mechanotransduktion. Wir erwarten neue Einblicke in grundlegende Prinzipien der Osteoblasten/Osteozyten Transition, der Regulation der Knochenmasse durch den osteozytären Feedback, und den Mineralisierungsprozess in den osteozytären Canaliculi. Die Mechanosensitivität der Osteozyten im Hinblick auf die FGFR1 Signaltransduktion und die Alterungsprozesse in Osteozyten und Konsequenzen für die Knochenbrüchigkeit und Osteoporose wird aufgeklärt werden. Die neuen Erkenntnisse könnten dazu dienen, neue Zielgene für Störungen des Knochenmetabolismus wie Osteoporose oder andere seltene Knochenerkrankungen zu identifizieren.
Projekt-assoziierte Publikationen:
- Hofmann C, Liese J, Schwarz T, Kunzmann S, Wirbelauer J, Nowak J, Hamann J, Girschick H, Graser S, Dietz K, Zeck S, Jakob F, Mentrup B. Compound heterozygosity of two functional null mutations in the ALPL gene associated with deleterious neurological outcome in an infant with hypophosphatasia. Bone. 2013 Jul;55(1):150-7. doi: 10.1016/j.bone.2013.02.017. Epub 2013 Feb 27.
- Mentrup B, Marschall C, Barvencik F, Amling M, Plendl H, Jakob F, Beck C. Functional characterization of a novel mutation localized in the start codon of the tissue-nonspecific alkaline phosphatase gene. Bone. 2011 Jun 1;48(6):1401-8. doi: 10.1016/j.bone.2011.03.676. Epub 2011 Mar 16.
Auszeichnungen:
HPP-Award 2011 des Bundesverbands Hypophosphatasie Deutschland e.V.
an Frau Dr. rer. nat. Birgit Mentrup und Frau Dr. med. Christine Beck (Universitätskinderklinik) für die Arbeit "Mentrup B, Marschall C, Barvencik F, Amling M, Plendl H, Jakob F, Beck C. Functional characterization of a novel mutation localized in the start codon of the tissue-nonspecific alkaline phosphatase gene. Bone. 2011 Jun 1;48(6):1401-8. Epub 2011 Mar 16."