Kleine Unterschiede mit großer Wirkung
12.06.2023Wie unsere Gene die Immunantwort auf Krankheitserreger bestimmen, hängt von kleinsten Unterschieden im Erbgut ab. Die Situation ist komplex, wie eine neue Studie zeigt.
Nicht alle Menschen reagieren gleich auf denselben Infektionserreger: Manche erkranken sehr schwer, andere nur leicht, wieder andere womöglich gar nicht.
Für diese Variabilität gibt es viele verschiedene Ursachen. Ein wichtiger Grund ist, dass sich das Erbgut verschiedener Menschen voneinander unterscheidet. So können zum Beispiel im Genom einzelne Bausteine ausgetauscht sein – Fachleute sprechen in diesem Fall von Einzelnukleotid-Polymorphismen (single nucleotide polymorphisms, SNPs).
Wie beeinflussen solche kleinsten genetischen Unterschiede zwischen verschiedenen Menschen die Aktivierung des Immunsystems? Das haben Forschende aus Jena, Marburg und Würzburg in einer neuen Studie analysiert, die in der Fachzeitschrift Nature Communications veröffentlicht ist.
Die Federführung der Studie lag bei den Professoren Oliver Kurzai (Universität Würzburg / Leibniz-HKI) und Johannes Schumacher (Universität Marburg). Erstautor:innen sind Antje Häder und Dr. Sascha Schäuble, beide vom Leibniz-Institut für Naturstoff-Forschung und Infektionsbiologie (Leibniz-HKI). Oliver Kurzai leitet am Leibniz-HKI eine Forschungsgruppe sowie das Nationale Referenzzentrum für Invasive Pilzinfektionen.
Mindestens 745 reQTLs in Monozyten gefunden
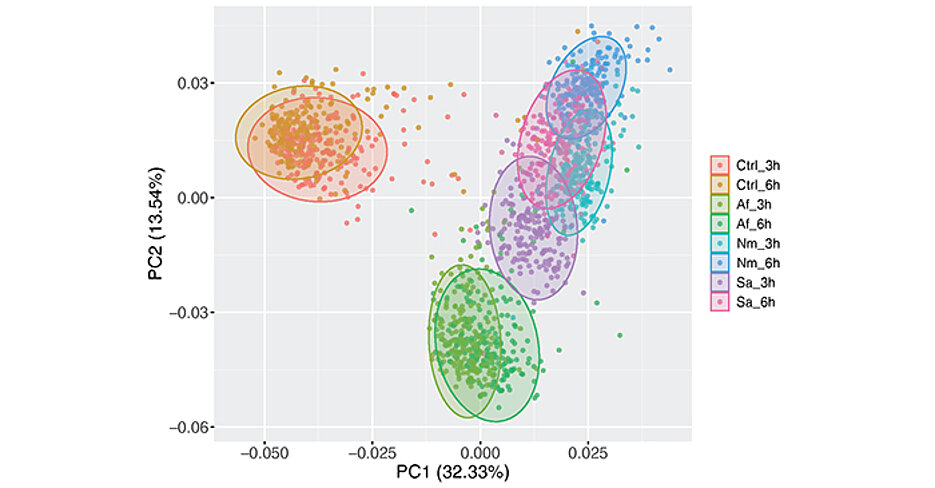
SNPs, die in Abhängigkeit von Bakterien oder Pilzen die Antwort der Zelle beeinflussen, nennt man reQTLs (response expression quantitative trait loci, reQTLs). Alleine in einem bestimmten Typus von Immunzellen, den Monozyten, identifizierte das Forschungsteam bei 215 Testpersonen mindestens 745 reQTLs, die die Aktivierung dieser Zellen beeinflussen, nachdem diese Kontakt mit Bakterien oder Pilzen hatten.
Der Einfluss ist komplex und variiert je nach Erreger. Einige reQTLs beeinflussen eher die Antwort auf bakterielle Erreger, andere eher die Antwort auf den Schimmelpilz Aspergillus fumigatus. Unter den aktivierten Genen, die durch reQTLs reguliert werden, sind insbesondere auch Gene, die zentrale immunlogische Zellfunktionen steuern. Die in der Studie gefundenen reQTLs könnten auch mit anderen Erkrankungen in Zusammenhang stehen, wie Krebs, Autoimmunität, Entzündungs- und Infektionskrankheiten.
Basiswissen für eine personalisierte Infektionsmedizin
„Unsere Studie leistet einen wichtigen Beitrag, um besser zu verstehen, wie der genetische Hintergrund einer Patientin oder eines Patienten die Auseinandersetzung mit Infektionserregern beeinflusst“, sagt Professor Oliver Kurzai. „Darüber müssen wir noch viel mehr lernen, wenn wir bei der Behandlung von Infektionskrankheiten einmal zu einer personalisierten Medizin kommen wollen, wie sie in der Krebstherapie schon länger etabliert ist – also zu einer Behandlung, die individuell auf jeden einzelnen Patienten und jede einzelne Patientin abgestimmt ist.“
Doch die neuen Daten zeigen auch, wie kompliziert eine klinische Umsetzung sein wird: „Für jeden Erreger scheint es andere genetische Marker zu geben, die die Immunantwort des Menschen regulieren – es bleibt also noch viel zu tun!“
Publikation
Häder, A., Schäuble, S., Gehlen, J. et al. Pathogen-specific innate immune response patterns are distinctly affected by genetic diversity. Nature Communications 14, 3239 (2023). Open Access: https://doi.org/10.1038/s41467-023-38994-5
Kontakt
Prof. Dr. Oliver Kurzai, Institut für Hygiene und Mikrobiologie, Universität Würzburg, T +49 931 31-46160, oliver.kurzai@uni-wuerzburg.de
Prof. Dr. Johannes Schumacher, Institut für Humangenetik, Universität Marburg, T +49 6421 58-66232, johannes.schumacher@uni-marburg.de