Krebs besser verstehen und stoppen
23.05.2023Im EU-Projekt ELMUMY untersucht die Universitätsmedizin Würzburg mit zwölf Partnern aus Wissenschaft und Industrie Faktoren, die die Entstehung und das Fortschreiten des Multiplen Myeloms beeinflussen.
Trotz bedeutender Fortschritte in der medizinischen Forschung ist das Gesamtverständnis von Krebs nach wie vor unvollständig – sowohl für häufige als auch für seltene Krebserkrankungen. Um die Risikofaktoren und Gesundheitsfaktoren, welche die Entstehung und das Fortschreiten von Krebs beeinflussen, besser zu verstehen, investiert die EU im Rahmen von Horizont Europa in neue vielversprechende und potenziell bahnbrechende Projekte.
Als besonders aussichtsreich wurde das Projekt ELMUMY bewertet. Das von der National and Kapodistrian University of Athens geleitete Verbundprojekt, an dem auch die Universitätsmedizin Würzburg mit Professor Hermann Einsele als Principle Investigator beteiligt ist, erhielt mit 14,5 von 15 Punkten die höchste Punktzahl und damit eine Förderung von 10 Millionen Euro. Davon gehen fast 1,5 Millionen nach Würzburg.
ELMUMY steht für Elucidation of Risk Factors and Health Determinants Associated with Progression of Monoclonal Gammopathies to Multiple Myeloma (MM). Ziel des Projekts ist es, die molekularen Mechanismen zu erforschen, die an der Entstehung und dem Fortschreiten der Krankheit beteiligt sind, und neue therapeutische Strategien zu entwickeln, die auf die besonderen Merkmale jedes einzelnen Betroffenen zugeschnitten sind.
Risiko bei monoklonaler Gammopathie
Normalerweise produziert der Körper eine Vielzahl verschiedener Antikörper, die dazu beitragen, den Körper vor diversen Infektionen zu schützen. Bei einer monoklonalen Gammopathie produzieren jedoch eine Plasmazelle und deren Tochterzellen, man spricht von Klonen, eine bestimmte Art von Antikörpern in großen Mengen.
Diese Antikörper werden als "monoklonale Proteine" oder "M-Proteine" bezeichnet und können im Blut und manchmal auch im Urin nachgewiesen werden. Ab einem gewissen Grad kann dies erhebliche Gesundheitsprobleme verursachen, wie zum Beispiel eine erhöhte Infektanfälligkeit.
Mit dem Alter steigt das Risiko für eine monoklonale Gammopathie. Bei drei bis fünf Prozent der alternden Bevölkerung in Europa tritt eine monoklonale Gammopathie unklarer Signifikanz (MGUS) auf. Die Auswirkungen sind äußerst vielfältig, und die Behandlungen hängen von der Ursache, der Art der Störung sowie vom Krankheitsstadium ab. Jedes Jahr entwickelt eine von 100 Personen mit MGUS ein schwelendes Multiples Myelom (sMM) oder ein aktives MM. Warum das so ist und wie sich die Krebsvorstufen rechtzeitig erkennen lassen, wird im Projekt ELMUMY untersucht.
Fortschreiten von MM von vornherein verhindern
„Das Multiple Myelom ist eine Krebserkrankung des blutbildenden Systems, die sich durch langsames Fortschreiten und Rückfälle auszeichnet und für die es derzeit noch keine Heilung gibt“, erklärt Professor Hermann Einsele, Direktor der Medizinischen Klinik und Poliklinik II am Uniklinikum Würzburg (UKW), Standort-Sprecher des Nationalen Centrums für Tumorerkrankungen WERA und ELMUMY-Teilprojektkoordinator.
„Obwohl die jüngsten Fortschritte unser Verständnis der zellulären Funktionen erweitert haben, müssen kritische Aspekte dieser komplexen Pathologie noch erforscht werden. Würzburg wurde auch deshalb in das Konsortium mit eingebunden, weil hier das größte Myelom-Programm in Europa mit vielen klinischen Studien und Begleitforschung zu den neuesten Therapieformen, wie CAR-T-Zellen und verschiedenen T-Zell-aktivierenden (bispezifischen) Antikörpern angeboten wird.“
Um weitere biologische Wege und Moleküle zu identifizieren die für den Ausbruch, das Fortschreiten und die Therapieresistenz des MM verantwortlich sind, untersuchen die Beteiligten aus Wissenschaft und Industrie hochgradig annotierte Proben aus verschiedenen Krankheitsstadien (MGUS, sMM, MM) mit so genannten Omics-Technologien und bioinformatischen Ansätzen. Das UKW ist unter anderem für die Akquise der Proben zuständig, für multimodale durchflusszytometrische Analysen, für einzelmolekülempfindlichen Super-Resolution-Mikroskopie zur Visualisierung von Zielantigenen sowie für Mausmodelle.
Proben von Studienteilnehmenden werden analysiert
Bei den Proben handelt es sich um Blut von Patientinnen und Patienten, die an MM beziehungsweise einer Vorstufe erkrankt sind. Neben archivierten Proben, die in der Interdisziplinären Biomaterial- und Datenbank Würzburg (ibdw) eingefroren sind, werden im Rahmen und im Zeitraum des geförderten Projekts neue Proben gewonnen. Neben Alter und Geschlecht werden klinische Daten wie Zahl und Art der Vorbehandlungen sowie der Krankheitsverlauf erfasst. Für die genomische Charakterisierung der Myelomzellen spielt unter anderem die Durchflusszytometrie eine große Rolle.
Die Durchflusszytometrie ermöglicht eine hochempfindliche Tumordiagnostik. In Echtzeit können die Krankheitsbelastung und das Immunprofil des Betroffenen gemessen werden, was wiederum wertvolle Informationen über das Ansprechen der gewählten Therapie gibt.
Das Team von Professor Andreas Beilhack aus der Medizinischen Klinik und Poliklinik II führt seit mehr als zwei Jahren bei Patientinnen und Patienten mit MM regelmäßig Knochenmark- und Bluttests mit Durchflusszytometrie durch. „Mit diesem deutschlandweit einzigartigen Bluttest sind wir jetzt schon in der Lage, routinemäßig eine Myelomzelle unter einer Million gesunder Blutzellen zu erkennen. Aktuell verfeinert Dr. Paula Tabares aus meinem Team diese Methode weiter. Sie kann jetzt schon eine Myelomzelle unter 100 Millionen nachweisen“, berichtet der Mediziner und Immunologe.
Blockierung von Adhäsionsmolekülen
Doch welche Therapie ist die richtige? „So unterschiedlich die Erbgutveränderungen in den Plasmazellen sein können, die einem MM zugrunde liegen, so verschieden sind auch die Kommunikationswege der Myelomzellen mit ihrer Umgebung“, weiß Andreas Beilhack.
Die Progression des MM scheint stark von Wechselwirkungen mit dem Knochenmarksmikromilieu abzuhängen. Um sich auszubreiten, missbrauchen die Myelomzellen so genannte Adhäsionsmoleküle. So konnte Beilhacks Team nachweisen, dass hohe Expressionsspiegel des Zelladhäsionsmoleküls JAM-A in Myelom-Patientinnen und -Patienten wie auch in anderen Krebserkrankungen eine aggressive Krankheitsentwicklung begünstigt.
„Die Myelomzellen interagieren über JAM-A mit den Endothelzellen des Knochenmarks. Eine Blockierung von JAM-A könnte die ohnehin gestressten Myelomzellen noch mehr unter Druck setzen, sodass die Immunabwehr eine größere Chance hat, anzugreifen und das Fortschreiten der Erkrankung zu unterbinden“, so der Professor.
Tumorsphäroide aus Knochenmarkproben
„Und genau darum geht es uns: Wir wollen die Interaktion der Krebszellen mit der Gewebeumgebung stören und Kommunikationswege blockieren, um die körpereigenen Immunabwehrmechanismen zu reaktivieren“, fasst Beilhack zusammen.
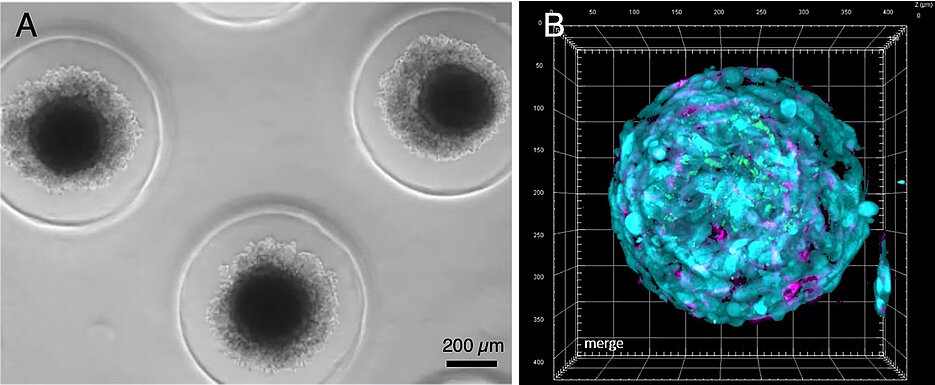
Ziel ist die personalisierte Medizin. Dafür hat sein Team dreidimensionale Tumorsphäroide aus Knochenmarkproben von Patientinnen und Patienten hergestellt. Mit diesen Mini-Knochenmark-Organoiden aus Stromazellen, Endothelzellen und Myelomzellen lässt sich gezielt untersuchen, welche Abwehrmechanismen der Krebszellen blockiert werden müssen, um durch eine therapeutische Manipulation eine schützende Immunantwort zu entfachen. Die Erkenntnisse sollen später in etablierten Mausmodellen validiert werden.
Erfolg der Immuntherapie hängt unter anderem von Antigenen auf Krebszellen ab
Einige Häuser weiter auf dem Gelände des Uniklinikums konzentriert sich Privatdozent Thomas Nerreter mit seinem Doktoranden, dem Physiker Peter Spieler, auf die Antigene. Die Wahl der Immuntherapie und ihr Erfolg hängt nämlich auch im entscheidenden Maße davon ab, ob, wie viele und welche Antigene sich auf der Krebszelle befinden.
Bei einer Antikörpertherapie werden den Betroffenen zum Beispiel künstliche Proteine infundiert, die mit den körpereigenen Immunzellen reagieren, indem sie an ihr entsprechendes Antigen binden, und so letztlich zu einem besseren Anti-Tumor-Effekt führen. Bei einer zellulären Immuntherapie werden dem Erkrankten Blutzellen entnommen und genmodifziert. Im Fall der am Lehrstuhl für Zelluläre Immuntherapie unter der Leitung von Professor Michael Hudecek durchgeführten Therapieform werden die körpereigenen T-Zellen mit einem auf die jeweilige Krebsart und das entsprechende Zielmolekül zugeschnittenen chimären Antigenrezeptor (CAR) ausgestattet. Diese CAR-T-Zellen können die Krebszellen, die auf ihrer Oberfläche das entsprechende Antigen tragen, erkennen und vernichten.
Zielmoleküle auf Myelomzelle sichtbar machen
Die Durchflusszytometrie benötigt für einen sicheren Nachweis von Antigenen rund 1.000 Moleküle eines Antigens auf einer Zelle. Beim hochempfindlichen Super-Resolution-Mikroskopieverfahren, das Professor Markus Sauer, Leiter des Lehrstuhls für Biotechnologie und Biophysik der Julius-Maximilians-Universität Würzburg (JMU) entwickelt hat, können jedoch schon Zielmoleküle im einstelligen Bereich auf Krebszellen sichtbar gemacht werden.
„Und tatsächlich reichen schon geringste Mengen dieser Zielmoleküle aus, um die Tumorzelle für die CAR-T-Zellen sichtbar und angreifbar zu machen“, erklärt Thomas Nerreter. Der Biologe hat bereits vor vier Jahren einzelmolekülempfindliche Super-Resolution-Mikroskopieverfahren eingesetzt, um gezielt nach dem CD19-Molekül auf Myelomzellen zu suchen – und zu finden, 2019 veröffentlicht in der Fachzeitschrift Nature Communications. „Mit Hilfe der hochauflösenden Mikroskopie konnten wir zeigen, dass das CD19-Antigen tatsächlich deutlich häufiger auf Myelomzellen zu finden ist als das mit klassischen Detektionsmethoden erkennbar war“, resümiert Nerreter.
Kompatible und kombinierbare Datensätze
Das Würzburger Team ist begeistert von dem ELMUMY-Projekt, an dem mehrere universitäre und industrielle Einrichtungen aus vielen europäischen Ländern beteiligt sind. Das multinationale Konsortium fördert die interdisziplinäre Kommunikation, indem es klinisch Tätige und Forschende zusammenbringt, die auf das Multiple Myelom, die Epidemiologie, Mausmodelle, Omics, Bioinformatik und Methoden der Künstlichen Intelligenz (KI) spezialisiert sind.
Ein ganz wichtiger Aspekt von ELMUMY ist Thomas Nerreter zufolge, dass alle Daten gleichsam erhoben und annotiert werden, damit Datensätze von verschiedenen Standorten kompatibel sind und kombiniert werden können.
Andreas Beilhack betont zudem, dass die Stiftung „Forschung hilft“ aus Würzburg einen entscheidenden Beitrag zur Krebsforschung geleistet hat, indem sie durch ihre Initiative und private Spenden den wesentlichen Grundstein für das ELMUMY-Projekt gelegt hat. Der Wissenschaftler ist davon überzeugt, dass die Zusammenarbeit internationaler Expertinnen und Experten nun dazu beitragen wird, weitere bedeutende Fortschritte im Verständnis und der Therapie der Krankheit zu erzielen.